8. Vahvat sidokset
8.1 Tavoitteet
Tavoitteena on, että tämän kappaleen jälkeen
- Tiedät mitä metallisidos tarkoittaa ja osaat antaa esimerkkejä aineista, joiden välillä on metallisidos
- Osaat perustella metallien ominaisuuksia metallisidosten avulla
- Tiedät mitä ionisidos tarkoittaa ja osaat antaa esimerkkejä yhdisteistä, joissa on ionisidos
- Osaat perustella ioniyhdisteiden ominaisuuksia ionisidoksen avulla
- Tiedät mitä kovalenttinen sidos tarkoittaa ja osaat antaa esimerkkejä yhdisteistä, joissa on kovalenttinen sidos
- Osaat selittää, mitä elektronegatiivisuus tarkoittaa
- Tiedät mitä poolinen kovalenttinen sidos tarkoittaa ja osaat antaa esimerkkejä yhdisteistä, joissa on poolinen kovalenttinen sidos
- Osaat selittää, kuinka metallisidos, ionisidos ja kovalenttinen sidos eroavat toisistaan submikroskooppisella tasolla
8.2 Vahvat sidokset ja kemian kolme tasoa
Aineen makroskooppisella tasolla havaitut ominaisuudet seuraavat sen submikroskooppisen tason rakenteesta ja erityisesti siitä, kuinka aineen perusosaset ovat sitoutuneet toisiinsa. Näistä ominaisuuksista voisi mainita esimerkkeinä aineen sulamis- ja kiehumispisteet, sähkön- ja lämmönjohtavuuden, kovuuden ja muokattavuuden.
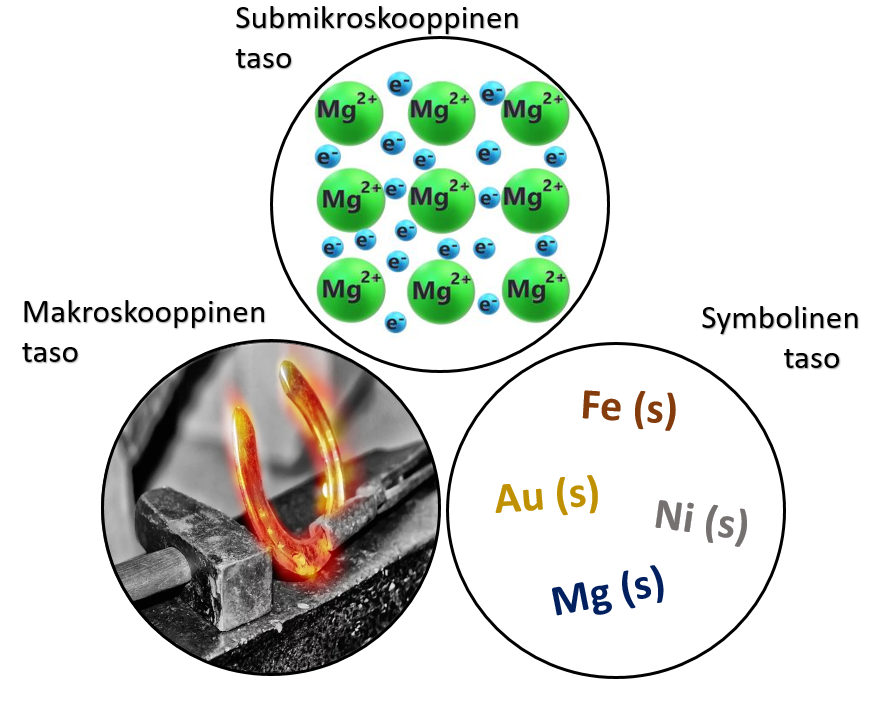
Symbolisella tasolla ainetta kuvataan yleensä kemiallisten merkkien ja lyhenteiden avulla. Esimerkiksi Fe (s) tarkoittaa kiinteässä olomuodossa olevaa rautaa. Kokenut kemian opiskelija ajattelee tämän merkinnän nähdessään rautakappaletta ja mielessään pystyy kuvittelemaan, miten rautakappaletta mallinnetaan submikroskooppisella tasolla.
Symbolisen tason esitys ei yleensä kerro, millä tavalla aineen perusosaset ovat sitoutuneet toisiinsa. Verrataan esimerkiksi suolan ja sokerin kemiallisia kaavoja: ja
. Suola ja sokeri näyttävät makroskooppisella tasolla hiukan samanlaisilta, mutta ne sitoutuvat toisiinsa hyvin eri tavoilla. Suola koostuu ioneista, jotka ovat järjestäytyneet säännölliseen ionihilaan. Sokeri taas muodostuu molekyyleistä, joissa atomit ovat sitoutuneet toisiinsa kovalenttisin sidoksin. Jos liuotat suolan veteen, se liukenee natrium- ja kloridi-ioneina. Sokeri taas liukenee kokonaisina molekyyleinä.
8.3 Kemialliset sidokset perustuvat atomien ja ionien väliseen sähköiseen vuorovaikutukseen
Olemme tähän mennessä käsitelleet aineiden peruspalikoita, atomeja ja ioneja. Ne eivät kuitenkaan juuri koskaan esiinny yksittäisinä luonnossa, vaan ne ovat yhdistyneet toisiinsa muodostaen molekyylejä, metallihiloja, ionihiloja ja muita rakenteita. Näitä atomeja, ioneja ja molekyylejä yhdistäviä voimia kutsutaan sidoksiksi.
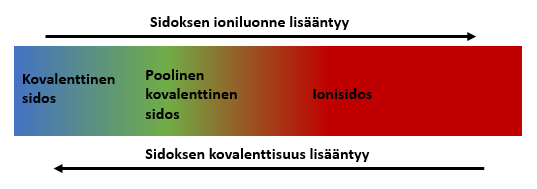
Sidokset voidaan jakaa eri tyyppisiin sidoksiin, mutta jako erilaisiin sidoksiin ei ole kovin terävärajainen.
Sidostyypit voi paremmin nähdä katkeamattomana janana, jossa toisessa päässä on ionisidos ja toisessa kovalenttinen sidos.
Vahvat sidokset voidaan kuitenkin karkeasti jakaa kolmeen päätyyppiin:
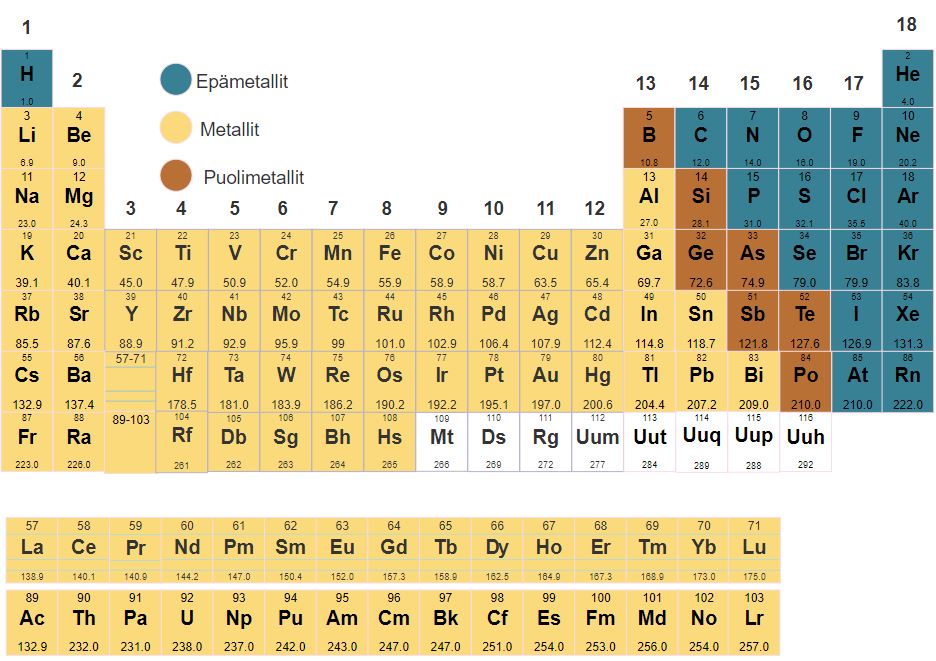
- Ionisidos muodostuu metallin ja epämetallin välille
- Kovalenttinen sidos muodostuu epämetallien välille
- Metallisidos muodostuu metallien välille
Kaikki kemialliset sidokset perustuvat pohjimmaltaan samaan asiaan - sähköiseen vuorovaikutukseen. Tiedämme, että erimerkkiset varaukset vetävät toisiaan puoleensa ja että samanmerkkiset varaukset hylkivät toisiaan. Tästä syystä esimerkiksi positiivinen kationi vetää puoleensa negatiivisia anioneja.
Myös atomien välillä on sähköisiä vuorovaikutuksia. Atomissa on sähköisesti varautuneita osia, protonit ytimessä ja elektronit elektronipilvessä. Kun atomit ovat tarpeeksi lähellä toisiaan, atomin ydin vetää puoleensa myös viereisen atomin elektroneja. Toisaalta atomien positiiviset ytimet pyrkivät hylkimään toisiaan ja negatiiviset elektronit hylkivät toisiaan.
8.4 Metallisidos
Monet arkisessa käytössä olevat esineet ovat metallia tai niissä on ainakin metallisia osia. Ruokaa paistaessasi käytät usein metallista pannua ja valmistamaasi ruokaa syöt metallisilla ruokailuvälineillä. Tietokoneessa on useita metallisia osia ja tietokone tarvitsee sähköä toimiakseen. Pistorasiasta sähkö siirtyy tietokoneeseen metallisia johtoja pitkin, jotka on päällystetty eristävällä muovikerroksella. Metalleilla onkin monia hyödyllisiä ominaisuuksia, kuten sähkön- ja lämmönjohtavuus sekä hyvä muokattavuus. Mistä nämä ominaisuudet johtuvat?

Metalliesineessä metalliatomit ovat sitoutuneet toisiinsa metallisidoksilla. Metalleilla on säännöllinen metallihila. Metallihilalla tarkoitetaan rakennetta, jossa metalliatomit ovat järjestäytyneet säännölliseen kolmiulotteiseen rakennelmaan eli hilaan, luovuttaneet ulkoelektroninsa yhteiseen elektronipilveen ja näin niistä on muodostunut positiivisia metalli-ioneja eli kationeja. Metallihilassa elektronit pääsevät liikkumaan vapaasti katonien välillä. Positiivisten kationien ja negatiivisten elektronien välillä on voimakas sähköinen vetovoima, jota kutsutaan metallisidokseksi.
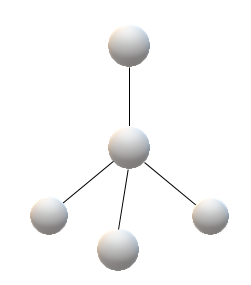
Metallisidosta mallinnetaan usein elektronimerimallilla, jossa metallikationit ovat vapaasti liikkuvien elektronien meressä. Elektronimerimallia on havainnollistettu alla olevassa kuvassa.

Metallisidos voi syntyä joko puhtaiden metallien välille tai metalliseosten välille. Metalliseoksissa on useampaa metallia toisiinsa sekoittuneina. Metalliseosta kutsutaan usein myös nimellä lejeerinki. Esimerkkejä lejeeringeistä ovat esimerkiksi pronssi, valkokulta tai ruostumaton teräs. Metalliseoksissa metallisidos muodostuu samalla tavoin kuin puhtaassa metallissa: metalliatomit luovuttavat ulkoelektronit yhteiseen käyttöön ja metallikationit muodostavat metallihilan.
8.4.1 Metallien ominaisuuksien ja rakenteen yhteys
Miten metallien luonteenomaiset ominaisuudet voidaan selittää metallisidoksen avulla?
Metallien sähkönjohtavuus
Metallihilassa elektronit pääsevät liikkumaan vapaasti ja pystyvät näin kuljettamaan sähkövirtaa
Jos ylimääräisiä elektroneja laitetaan metallikappaleen toiseen reunaan, syntyy elektronien välille välittömästi hylkiviä vuorovaikutuksia, jolloin sama määrä elektroneja poistuu toisesta reunasta.
Metallien muokattavuus
- Vapaasti liikkuvien elektronien ansiosta kationikerrokset pääsevät liikkumaan toistensa ohi niin, etteivät metallikationit joudu liian lähelle toisiaan. Metallikationit ovat positiivisia, joten jos ne joutuisivat liian lähelle toisiaan, syntyisi hylkiviä vuorovaikutuksia ja rakenne hajoaisi.
Metallien lämmönjohtavuus
Metallien hyvään lämmönjohtokykyyn vaikuttaa sekä metallihilan tiivis rakenne että vapaasti liikkuvat elektronit
Kun metallia lämmitetään toisesta reunasta, lämmitetyn reunan metallihilan metallikationit alkavat liikkua voimakkaammin paikoillaan. Koska metallikationit ovat pakkautuneet ionihilaan tiiviisti, lämmitetyt metallikationit törmäilevät viereisiin kationeihin ja saavat nekin värähtelemään. Tällä tavoin energia johtuu joka puolelle metallihilaa.
Myös vapaat elektronit kuljettavat lämpöenergiaa. Kun toista reunaa lämmitetään, reunassa olevat elektronit alkavat liikkumaan nopeammin ja voivat törmätä kylmemmän pään kationeihin ja saada ne näin värähtelemään voimakkaammin.
Metallien korkea sulamispiste ja kiehumispiste
- Metallisidos on vahva, joten tarvitaan paljon energiaa sidosten katkaisemiseksi. Jotta metalli voi muuttua nesteeksi tai kaasuksi, tarvitaan metallisidosten katkaisemiseen paljon lämpöenergiaa.
8.5 Kovalenttinen sidos
Monet arkipäivän aineet, kuten hiilidioksidi (), vesi (
), metaani (
) ja sokeri (
) ovat molekyyliyhdisteitä eli atomit ovat sitoutuneet toisiinsa kovalenttisilla sidoksilla, muodostaen yhteen liittyneiden atomien ryppään eli molekyylin.
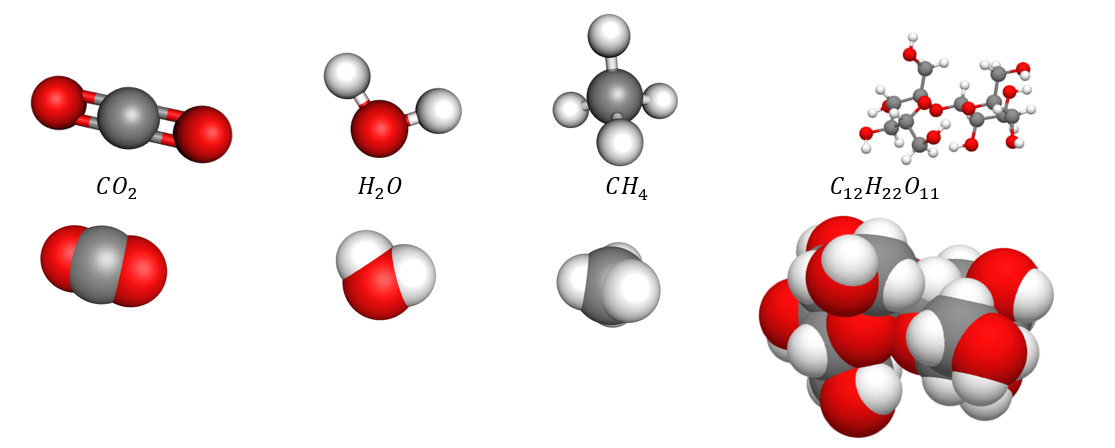
Myös monet epämetalliset alkuaineet esiintyvät luonnossa molekyylimuodossa. Esimerkiksi useimmat ilmakehän kaasuista esiintyvät molekyylimuodossa, kuten happi ja typpi kaksimolekyylisenä happikaasuna ja typpikaasuna ( ja
). Näissä molekyyleissä kahden atomin välillä on kovalenttinen sidos.
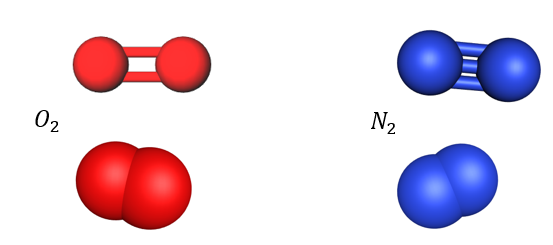
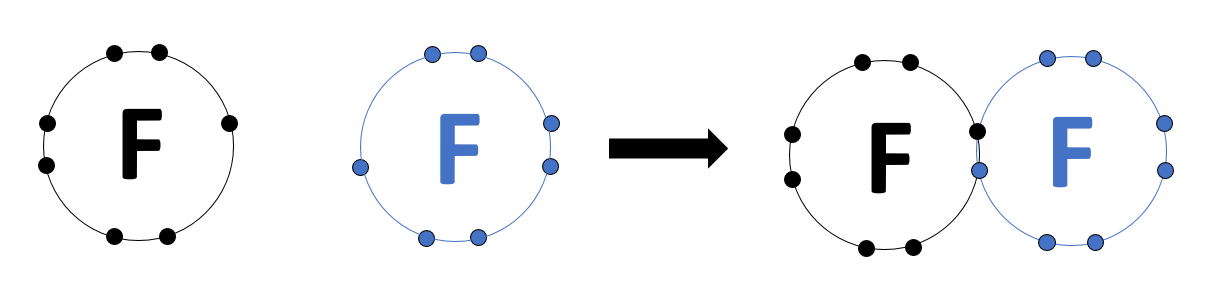
Kovalenttisessa sidoksessa atomit pysyvät yhdessä sidoksilla, jotka muodostuvat yhden tai useamman elektroniparin jakamisesta. Kun molempien atomien ytimet vetävät puoleensa yhteisiä sidoselektroneja, syntyy sidos, jota kutsutaan kovalenttiseksi sidokseksi. Positiivisten ytimien vetovoima atomien välillä oleviin negatiivisiin elektroneihin pitää atomit yhdessä.
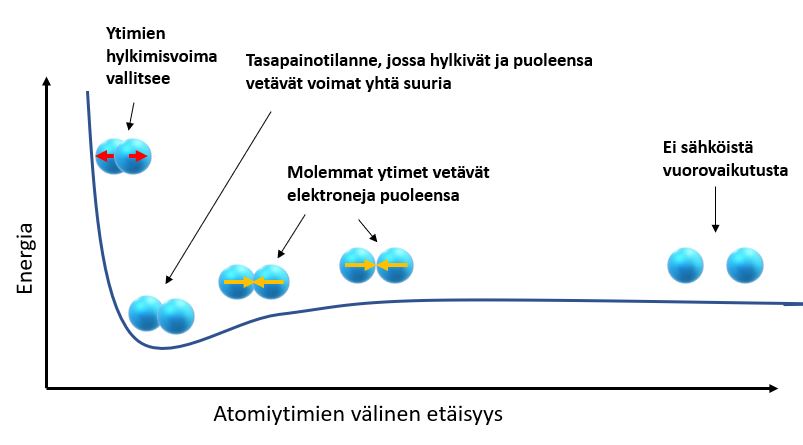
Atomiytimet ja elektronit vetävät toisiaan puoleensa tiettyyn pisteeseen asti, kunnes samanmerkkiset varaukset ovat niin lähellä toisiaan, että niiden hylkimisvoima on tasapainossa puoleensa vetävän voiman kanssa. Tätä tilannetta voidaan kuvata alla olevalla kaaviolla, josta nähdään, että
Atomien ollessa riittävän kaukana toisistaan, ei niiden välillä ole vetovoimaa.
Kun atomit lähestyvät toisiaan, kummankin atomin ytimet vetävät elektroneja puoleensa ja tästä syystä atomit vetävät toisiaan puoleensa.
Jos atomiytimet joutuvat liian lähelle toisiaan, niiden hylkimisvoima kasvaa suuremmaksi kuin ytimien ja elektronien välinen vetovoima ja atomit siirtyvät kauemmaksi toisistaan
Tasapainotilanteessa hylkimisvoima ja vetovoima ovat tasapainossa. Huomaa, että tämä on samalla tila, jolla energia on kaikkein matalin.
Kovalenttista sidosta mallinnetaan usein atomien välille piirretyn viivan avulla. On kuitenkin hyvä muistaa, että todellisuudessa atomien välillä ei ole tikkua tai lankaa, joka pitää niitä yhdessä, vaan sähköinen vetovoima sitoo ne yhteen. Kovalenttinen sidos voi olla yksöissidos, kaksoissidos tai kolmoissidos. Tämä viittaa jaettujen elektroniparien lukumäärään. Yksöissidoksessa atomien välillä on yksi jaettu elektronipari. Vastaavasti kaksoissidoksessa on kaksi jaettua elektroniparia ja kolmoissidoksessa kolme. Kaksoissidoksen tapauksessa atomimallissa piirretään kaksi viivaa atomien välille ja kolmoissidoksessa viivoja piirretään kolme.
Atomien sitoutuessa toisiinsa kovalenttisin sidoksin, syntyy atomirypäs, jota kutsutaan molekyyliksi. Molekyyli on kuitenkin vielä mikroskooppisen pieni, joten tarvitaan voimia, jotka sitovat molekyylit yhteen. Näitä molekyylit toisiinsa sitovia voimia kutsutaan heikoiksi sidoksiksi ja niitä käsitellään tarkemmin vasta seuraavassa kappaleessa.
8.6 Kovalenttinen hila
Kovalenttisilla sidoksilla voi joissain tapauksissa muodostua myös hilarakenteita, joita kutustaan kovalenttisiksi hiloiksi. Kovalenttisessa hilassa atomit ovat järjestäytyneet säännölliseen hilarakenteeseen ja atomit ovat sitoutuneet toisiinsa kovalenttisin sidoksin.
Esimerkiksi timantti koostuu äärettömän suuresta määrästä hiiliatomeja, jotka ovat sitoutuneet toisiinsa kovalenttisilla sidoksilla. Jokainen hiiliatomi muodostaa kovalenttisen sidoksen neljän muun hiiliatomin kanssa. Kovalenttiset sidokset hiilten välillä ovat vahvoja sidoksia ja niiden katkaisemiseen tarvitaan paljon energiaa. Timantin rakenne onkin erittäin vahva ja sitä pidetään yhtenä maailman kovimmista aineista.

Myös grafiitti on hiilen muodostama hilarakenne, jossa hiilet ovat sitoutuneet toisiinsa kovalenttisin sidoksin. Grafiitissa hiilet ovat järjestäytyneet kuusikulmioista koostuvaan tasomaiseen hilarakenteeseen. Tasot ovat sitoutuneet toisiinsa vain heikoin sidoksin. Grafiittia käytetään esimerkiksi lyijykynän lyijynä, joten se on huomattavasti timanttia pehmeämpää materiaalia.
8.7 Poolinen kovalenttinen sidos
8.7.1 Elektronegatiivisuus
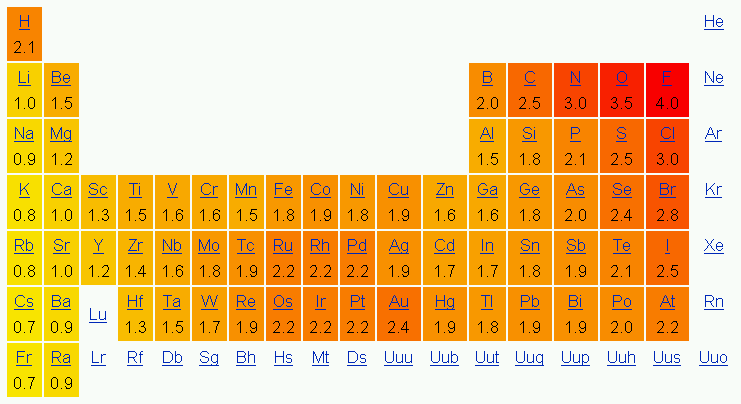
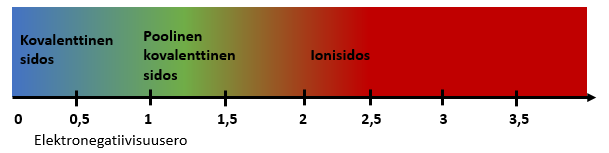
Elektronegatiivisuudella tarkoitetaan atomien kykyä vetää sidoselektroneja puoleensa. Mitä suurempi elektronegatiivisuus, sitä voimakkaammin atomi vetää elektroneja puoleensa. Atomien elektronegatiivisuudet on esitetty alla olevassa jaksollisessa järjestelmässä, mutta ne löytyvät myös taulukkokirjasta. Elektronegatiivisuudella ei ole yksikköä.
8.7.2 Sidoksen poolisuus
Kahden saman alkuaineen atomin sitoutuessa toisiinsa, molempien atomien ytimet vetävät elektroneja puoleensa yhtä voimakkaasti. Tällöin elektronit jakautuvat symmetrisesti molemmille atomeille, eikä kumpikaan atomeista saa enempää elektroneja kuin toinenkaan. Saman alkuaineen atomien sidokset ovatkin puhtaasti kovalenttisia sidoksia, eli elektronit jakautuvat tasaisesti niiden välillä.
Esimerkiksi kahden fluoriatomin muodostaessa fluorimolekyylin , jakaantuvat elektronit symmetrisesti molemmille atomeille. Fluorin elektronegatiivisuus on 4,0, joten se vetää elektroneja voimakkaasti puoleensa. Molemmat fluorit vetävät kuitenkin elektroneja yhtä voimakkaasti puoleensa, joten kahden fluoriatomin välinen elektronegatiivisuusero on nolla (
).
Myös kahden vetyatomin muodostamassa vetymolekyylissä () molemmilla vedyillä elektronegatiivisuus on sama 2,1, joten elektronegatiivisuusero vetyjen välillä on
.
Vetyfluoridi (HF) on vedyn ja fluorin muodostama molekyyliyhdiste. Fluori on molekyylin atomeista elektronegatiivisempi ja fluorin ja vedyn elektronegatiivisuusero on . Tämä tarkoittaa sitä, että fluori vetää sidoselektroneja voimakkaammin puoleensa kuin vety. Epätasaiset puoleensa vetävät voimat johtavat sidoselektronien epätasaiseen jakautumiseen molekyylissä. Koska negatiiviset elektronit ovat lähempänä fluoriatomia, molekyylin fluoriosalla on negatiivinen osittaisvaraus ja vastaavasti molekyylin vetyosalla positiivinen osittaisvaraus. Osittaisvarauksia merkitään usein symboleilla δ- tai δ+. Merkintä δ on pieni kreikkalainen delta kirjain.
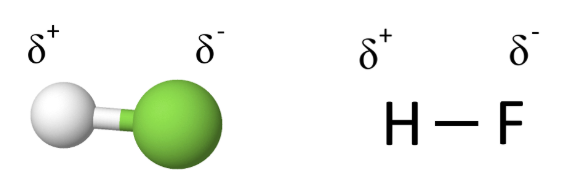
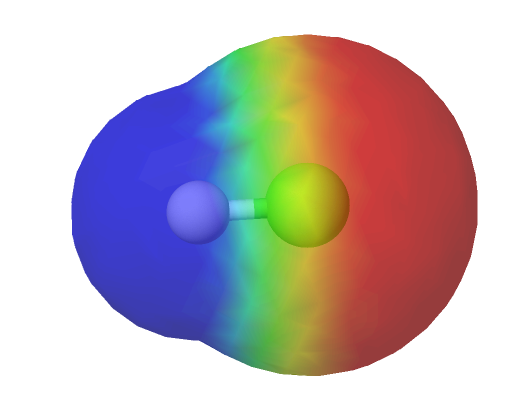
Elektronien epätasaista jakautumista eli poolisuutta voidaan mallintaa myös elektronitiheyspinnoilla, jossa väreillä kuvataan elektronitiheyttä. Sinisellä värillä kuvataan positiivista varausta ja punaisella värillä kuvataan negatiivista varausta. Elektronitiheys on siis suurempi punaisilla alueilla.
Kovalenttista sidosta, jossa sidoselektronit jakautuvat epätasaisesti, kutsutaan pooliseksi kovalenttiseksi sidokseksi.
Elektronegatiivisuuseron perusteella voidaan luokitella, onko sidos kovalenttinen sidos, poolinen kovalenttinen sidos vai ionisidos.
Elektronegatiivisuusero lasketaan yksinkertaisesti elektronegatiivisuuksien erotuksena.
Elektronegatiivisuusero Elektronegatiivisemman atomin elektronegatiivisuus
vähemmän elektronegatiivisen atomin elektronegatiivisuus
Elektronegatiivisuusero on 0,5 tai alle
Kovalenttinen sidos
Elektronegatiivisuusero välillä 0,5 – 1,7
Poolinen kovalenttinen sidos
Elektronegatiivisuusero yli 1,7
Ionisidos
Edellä kuvatut rajat eivät ole kovin jyrkkiä ja ehkä huomasitkin, että esimerkkinä käytetyn vetyfluoridin elektronegatiivisuusero on 1,9, joka viittaisi ionisidokseen. Tiedetään kuitenkin, että vetyfluoridin sidosta voi paremmin luonnehtia pooliseksi kovalenttiseksi sidokseksi. Yleisesti voidaan kuitenkin todeta, että mitä suurempi elektronegatiivisuusero, sitä enemmän sidoksella on ioniluonnetta.
Esimerkki
Laske elektronegatiivisuuserot ja päättele millainen sidos atomien välille muodostuu
a) H ja Br
b) H ja C
c) Li ja Cl
Vastaus
a) Vedyn elektronegatiivisuus on 2,1 ja bromin elektronegatiivisuus 2,8. Elektronegatiivisuusero saadaan laskemalla .
Koska elektronegatiivisuusero on 0,7, niin atomien välille muodostuu poolinen kovalenttinen sidos
b) Vedyn elektronegatiivisuus on 2,1 ja hiilen elektronegatiivisuus 2,5.
Elektronegatiivisuusero on vain 0,4 kovalenttinen sidos
c) Litiumin elektronegatiivisuus on 1,0 ja kloorin elektronegatiivisuus 3,0.
Elektronegatiivisuusero 2,0 ionisidos
8.8 Ionisidos
Kun elektronegatiivisuusero kasvaa riittävän suureksi, eli yleensä kun elektronegatiivisuusero on yli 1,7, elektronegatiivisempi atomi vetää elektroneja puoleensa niin paljon voimakkaammin, ettei voida enää puhua yhteisestä elektroniparista. Elektronegatiivisemmasta atomista muodostuu negatiivinen ioni eli anioni ja toisesta atomista positiivinen ioni eli kationi.
Ionisidos muodostuu yleensä metallin ja epämetallin välille. Epämetalleilla on korkea elektronegatiivisuus ja metalleilla yleensä selkeästi matalampi.
Ionisidos eroaa merkittävästi kovalenttisesta sidoksesta: ionisidoksessa ei ole yhteisiä sidoselektroneja. Sen sijaan ioniyhdisteitä pitää yhdessä ionien väliset voimakkaat sähköiset vetovoimat eli ionisidokset. Huomaa, että toisin kuin kovalenttisessa sidoksessa, ionisidoksessa sidos ei ole suuntautunut, vaan ioni vetää vastakkaismerkkisiä ioneja puoleensa joka puolelta. Ionisidoksessa ei siis muodostu molekyylejä, vaan kiinteässä ioniyhdisteessä kationit ja anionit järjestäytyvät ionihilaan, jossa jokainen kationi on anionien ympäröimä ja jokainen anioni kationien ympäröimä. Tällainen järjestäytyminen maksimoi kationien ja anionien välisen vetovoiman ja minimoi varaukseltaan samanlaisten ionien hylkimisen.
Esimerkiksi natriumkloridissa kuusi kloridi-ionia ympäröi jokaista natriumionia ja kuusi natriumionia ympäröi jokaista kloridi-ionia. Kuten NaCl:n kemiallisesta kaavasta nähdään, hilassa on samassa suhteessa natriumioneja ja kloridi-ioneja (suhteessa 1:1). Huomaa, että yksi natriumioni vetää puoleensa kaikkia kuutta sitä ympäröivää kloridi-ionia ja vastaavasti yksi kloridi-ioni vetää puoleensa kuutta natriumatomia.
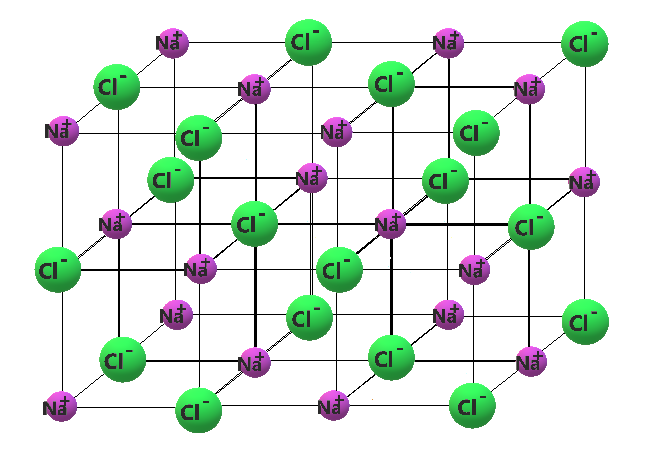

Koska ionit pystyvät hilarakenteessa vain heilahtelemaan paikoillaan, eivätkä pysty liikkumaan vapaasti, ioniset kiinteät aineet eivät johda sähköä. Ionihila myös murtuu helposti, eikä sitä voi muokata takomalla. Kun ionikerrokset liikahtavat niin, että vastakkaismerkkiset ionit osuvat vastakkain, samanmerkkiset varaukset hylkivät toisiaan ja hila hajoaa tästä kohdasta.
Ioniyhdisteen kemiallinen kaava kertoo ionien suhteen yhdisteessä. Se EI merkitse sitä, että koostuisi
molekyyleistä! Esimerkiksi ioniyhdisteen liuetessa veteen, se ei liukene
-perusyksikköinä, vaan
- ja
-ioneina. Vertaa tätä esimerkiksi sokeriin, joka liukenee molekyyleinä, ei ioneina! Ioniyhdiste liukenee aina veteen ioneina, molekyyliyhdiste (eli kovalenttisesti sitoutunut molekyyli) liukenee molekyyleinä.
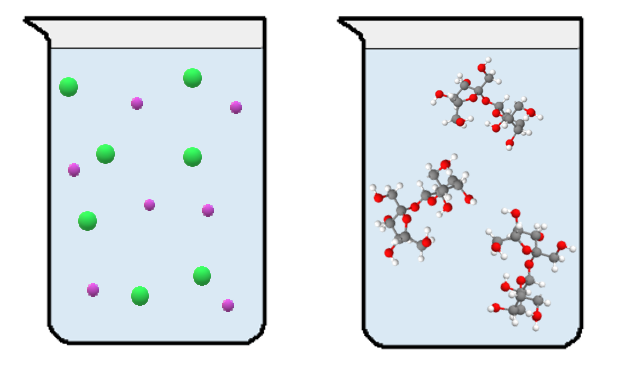
Veteen liuennut ioniyhdiste johtaa kuitenkin sähköä, koska varaukselliset ionit pääsevät liikkumaan vapaasti liuoksessa. Ioniyhdiste johtaa sähköä myös sulatteena (eli nestemäisessä muodossa), jolloin varaukselliset ionit pääsevät liikkumaan toistensa ohi.
8.9 Tehtävät ja lisämateriaali
Muita linkkejä opiskelun tueksi:
apukappale
These are the current permissions for this document; please modify if needed. You can always modify these permissions from the manage page.