11. Erilaiset sidokset, erilaiset ominaisuudet
11.1 Tavoitteet
Tavoitteena on, että tämän kappaleen jälkeen
Osaat kuvailla molekyyliyhdisteille, ioniyhdisteille ja metalleille tyypillisiä ominaisuuksia ja perustella niitä erilaisen rakenteen avulla
Osaat aineen rakenteen perusteella päätellä, millaisia ominaisuuksia sillä on
Osaat soveltaa aineen rakenteen malleja aineen ominaisuuksien vertailussa
Osaat tutkia aineen ominaisuuksia kokeellisesti ja tehdä kokeiden perusteella päätelmiä aineen rakenteesta
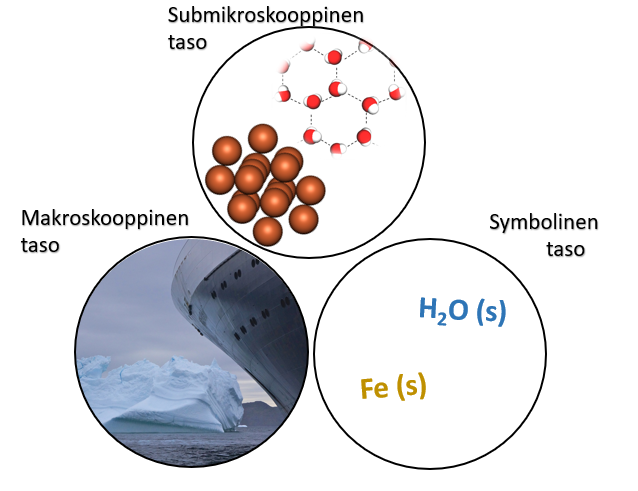
11.2 Aineen ominaisuudet ja kemian kolme eri tasoa
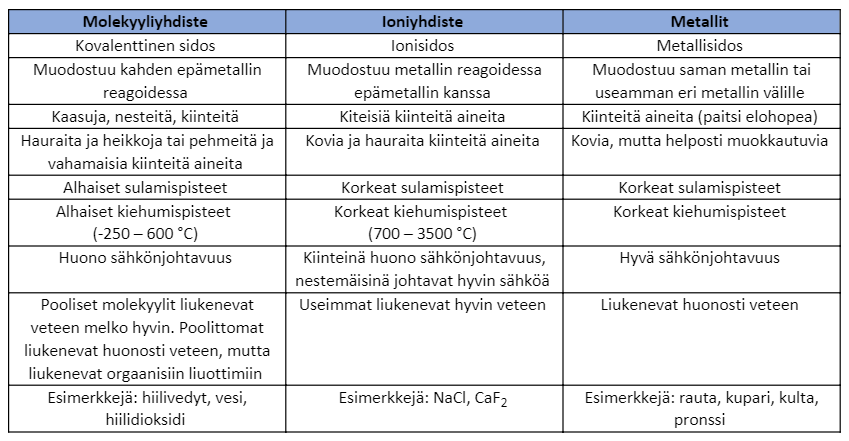
Joitakin aineiden ominaisuuksia pystytään ennustamaan, jos aineen rakenne tunnetaan. Jotkin ominaisuudet riippuvat voimakkaasti aineen perusosasten välisistä vetovoimista, sidoksista. Tällaisia ominaisuuksia ovat muun muassa sulamis- ja kiehumispisteet, liukoisuus, sähkönjohtavuus ja muokkautuvuus.
Makroskooppisella tasolla voidaan esimerkiksi havaita, että huoneenlämmössä vesi on nestemäisessä ja rauta kiinteässä olomuodossa. Toisaalta tiedetään, että submikroskooppisella tasolla vesimolekyylit ovat poolisia molekyylejä ja ne sitoutuvat tosiinsa vetysidoksin. Rauta taas on metalli ja sen rakennetta kuvataan metallihilalla, jossa rautakationit sitoutuvat toisiinsa vahvoin metallisidoksin. Sulamispisteeseen vaikuttaa aineen perusosasten välisien sidoksien lujuus. Raudan sulamispiste on 1538 °C, kun taas veden sulamispiste on 0 °C. Voidaan siis päätellä, että metallisidoksen rikkomiseen tarvitaan paljon enemmän energiaa, kuin vetysidoksen rikkomiseen.
Veden ja raudan ominaisuudet vaikuttavat siihen, kuinka näitä aineita voidaan hyödyntää. Raudasta voidaan esimerkiksi tehdä laivoja, talojen runkoja ja nauloja. Veden ominaisuudet taas eivät tee siitä käyttökelpoista materiaalia näihin tarkoituksiin. Kiinteästä vedestä voidaan toki voida rakentaa erilaisia rakennelmia, kuten lumilinnoja ja igluja, mutta ne sulavat lämpötilan noustessa plussan puolelle. Myöskään kiinteästä vedestä tehty naula ei ole järin kestävä; se hajoaa herkästi pienestäkin iskusta.
Symbolisella tasolla aineita voidaan kuvata kemiallisilla symboleilla ja olomuotomerkinnöillä. Merkintä tarkoittaa kiinteää vettä ja tässä vaiheessa kemian opintojasi pystyt mielessäsi kuvittelemaan, miltä jää näyttää makroskooppisella tasolla ja kuinka submikroskooppisella tasolla vesimolekyylit ovat sitoutuneet toisiinsa.
11.3 Sulamis- ja kiehumispisteet
Kiinteässä olomuodossa aineen perusosaset ovat järjestäytyneet hilarakenteeseen, joka pysyy kasassa vahvojen tai heikkojen sidosten avulla. Kiinteässäkään aineessa ionit, atomit tai molekyylit eivät ole pysähdyksissä, vaan ne värähtelevät hieman paikallaan. Kun ainetta lämmitetään, eli se saa lisää energiaa, aineen perusosasten värähteleminen voimistuu. Kun liike-energia kasvaa suuremmaksi kuin perusosaset paikoilleen sitova sähköinen vetovoima, sidos katkeaa. Kun aineeseen tulee riittävästi lämpöenergiaa ja hilarakennetta yhdessä pitävät sidokset katkeavat, niin aine muuttaa olomuotoaan kiinteästä nesteeksi.
Kullakin aineella on paineesta riippuva ominainen lämpötila, jossa sen perusosasten liike-energia riittää hajottamaan hilarakenteen. Tätä lämpötilaa kutsutaan aineen sulamispisteeksi.
Nestemäisessä olomuodossa molekyylit pääsevät liikkumaan vapaammin, mutta niiden välillä on edelleen sidoksia. Kun nestettä lämmitetään riittävästi, aineen perusosasten liike kasvaa niin suureksi, että sidokset katkeavat ja perusosaset pääsevät liikkumaan vapaasti ja hajaantuvat tasaisesti koko käytettävissä olevaan tilaan. Myös kiehumispiste on kullekin aineelle ominainen lämpötila, jossa se muuttaa olomuotoaan nesteestä kaasuksi.
Miten sitten erilaiset sidokset vaikuttavat sulamispisteeseen ja kiehumispisteeseen? Tiedämme, että useimmilla metalleilla on varsin korkea sulamispiste ja kiehumispiste. Myös useimmat ioniyhdisteet sulavat vasta korkeammissa lämpötiloissa. Ja mietipä timanttia, ehkäpä maailman kovinta luonnossa esiintyvää ainetta. Timantin sulamispiste on yli 3500 °C. Mitä yhteistä ja eroavaisuutta näillä rakenteilla on keskenään? Voitko päätellä jotain sidosten vahvuudesta sulamis- ja kiehumispisteiden avulla?
Vastaus
Metalleissa metallikationit ovat sitoutuneet toisiinsa vahvoilla metallisidoksilla muodostaen metallihilan
Ioniyhdisteissä ionit ovat sitoutuneet toisiinsa vahvoilla ionisidoksilla muodostaen ionihilan
Timantissa jokainen hiiliatomi on sitoutunut vahvoilla kovalenttisilla sidoksilla neljään muuhun hiiliatomiin, joista muodostuu kovalenttinen hila.
Kaikissa edellä mainituissa hilarakenteissa koossa pitävänä voimana on jokin vahva sidos
Mitä vahvemmat sidokset, sitä korkeammat sulamis- ja kiehumispisteet, sillä sidosten hajottamiseen tarvitaan enemmän (lämpö)energiaa
Tarkastellaan sitten veden sulamispistettä verrattuna suunnilleen samankokoisiin molekyyleihin. Miksi vesi on kiinteässä olomuodossa jo nollan asteen alapuolella, mutta hiilidioksidi jäätyy vasta kun lämpötila putoaa alle - 78°C?
Vastaus
Vesimolekyylien välillä täytyy siis olla vahvempia sidoksia kuin hiilidioksidimolekyylien välillä.
Vesimolekyyli on poolinen molekyyli ja vesimolekyylien välille muodostuu vetysidoksia, jotka ovat heikoista sidoksista vahvimpia
Hiilidioksidimolekyyli on pooliton, joten hiilidioksidimolekyylien välille muodostuu vain heikkoja dispersiovoimia.
11.4 Samanlainen liuottaa samanlaista
Karkeasti jaettuna ioniyhdisteet liukenevat hyvin veteen, kun taas poolittomat molekyyliyhdisteet eivät kovin hyvin. Tämä johtuu siitä, että vesi on poolinen ja olet todennäköisesti joskus kuullutkin, että samanlainen liuottaa samanlaista. Muistisääntö viittaa siihen, että poolinen aine liukenee hyvin pooliseen liuottimeen ja pooliton aine liukenee hyvin poolittomaan liuottimeen.
Kun ioniyhdiste laitetaan veteen, vesimolekyylit vetävät ioneja puoleensa ja ionit irtoavat yksitellen hilasta. Lämmitys tai sekoittaminen auttaa ionien irrottamiseen hilasta.
Poolittomat molekyylit sitä vastoin ovat sähköisesti neutraaleja, joten vesimolekyylit eivät vedä niitä puoleensa yhtä voimakkaasti. Tästä syystä poolittomat molekyylit liukenevat veteen usein paljon huonommin kuin pooliset molekyylit tai ioniyhdisteet.
Ioniyhdisteet liukenevat veteen ioneina ja molekyyliyhdisteet liukenevat veteen molekyyleinä. Huomaa, että myös jotkin suolat eli ioniyhdisteet ovat niukkaliukoisia, jolloin ne eivät juuri liukene veteen.
11.5 Sähkönjohtavuus
Aineilla, joissa varaukselliset hiukkaset (elektronit tai ionit) pääsevät liikkumaan vapaasti, on hyvä sähkönjohtokyky. Tunnetusti metallit johtavat hyvin sähköä, koska niiden elektronimeressä olevat ulkoelektronit pääsevät liikkumaan vapaasti.
Ioniyhdiste ei johda sähköä kiinteässä olomuodossa, koska ionit ovat sitoutuneet säännölliseen kiderakenteeseen, eivätkä pääse liikkumaan. Ioniyhdiste johtaa kuitenkin sähköä sulatteena, sillä nestemäisessä muodossa ionit pystyvät liikkumaan liuoksessa.
Miksi ioniyhdiste johtaa sähköä veteen liuenneena?
Vastaus
- Ioniyhdiste liukenee veteen ioneina, jolloin ne pääsevät liikkumaan vapaasti
Johtaako molekyyliyhdiste sähköä kiinteässä olomuodossa, nestemäisessä olomuodossa tai veteen liuenneena?
Vastaus
- Molekyyleillä ei ole sähkövarausta, joten niillä on huono sähkönjohtokyky
11.6 Muokkautuvuus
Jos lyöt vasaralla metallia, se muokkautuu iskujen voimakkuuden mukaan. Jos lyöt samalla voimalla suolakidettä, se halkeaa tai murtuu erilaisiksi palasiksi. Ioniyhdiste hajoaa, koska samanmerkkiset varaukset hylkivät toisiaan. Jos anionit ja kationit pakotetaan liian lähelle samanmerkkisiä ioneja, syntyy toisiaan pois työntäviä vuorovaikutuksia ja ionihila hajoaa tästä kohdasta.
Mistä johtuu, että myös kiinteässä olomuodossa oleva vesi eli jää murtuu, eikä sitä voi muotoilla kuten metallia?
Vastaus
- Kun jäähän kohdistuu riittävän kova isku, vesimolekyylit liikahtavat ja vetysidokset katkeavat

11.7 Yhteenveto
Huomioi, että kaikki edellä kuvatut erilaisten sidostyyppien ominaisuudet ovat vain yleistyksiä. Vaikka useimmiten ioniyhdisteillä on korkeammat sulamispisteet kuin molekyyliyhdisteillä, tulet varmasti törmäämään ioniyhdisteisiin matalalla sulamispisteellä ja toisinpäin.
11.8 Aineiden ominaisuuksien tutkiminen kokeellisesti
Tässä työssä tutkitaan aineiden ominaisuuksia ja päätellään sen perusteella, millaisia sidoksia aineissa on. Työ koostuu kolmesta eri tutkimuksesta samoille aineille.
Vinkki: Työ voidaan suorittaa myös tuntemattomilla aineilla, jolloin opiskelijoille paljastetaan aineiden nimet vasta tutkimusten jälkeen.
Tarvittavat välineet:
- Kiinteitä aineita (esim. Sakkaroosi,
,
,
, Sitruunahappo, Sooda, Rikki, Glukoosi)
- Jokaiselle aineelle puhdas lusikka
- Suojalasit
Tee taulukko ja täydennä taulukkoon yhdisteiden nimet. Tarkastele kutakin tutkittavaa ainetta ja kuvaile sen ulkonäköä. Kirjaa havaintosi taulukkoon.
Osa 1: Sulamispiste
Tarvittavat välineet:
- Kaasupoltin ja tulitikut
- Kolmijalka (tai statiivi, koura ja metallirengas)
- Palanen kaksin- tai kolminkerroin taitettua alumiinifoliota
Työohjeet:
Aseta alumiinifolion palanen kolmijalan tai metallirenkaan päälle. Tarkista myös, että kaasupoltin mahtuu alumiinifolion alapuolelle!
Aseta lusikan kärjellinen jokaista tutkimaasi ainetta alumiinifolion päälle. Varmista, etteivät aineet sekoitu ja pidä huolta, että tiedät mikä aine on missäkin kohdassa!
Sytytä kaasupoltin ja aseta se varovasti alumiinifolion alapuolelle.
Tee havaintoja, kun aineet alkavat lämmetä. Kirjaa ylös järjestys, jossa aineet sulavat.
Noin kolmen minuutin jälkeen sammuta kaasupoltin ja merkitse ylös, mitkä aineet eivät sulaneet.
Täydennä taulukkoon kunkin aineen kohdalle sulamispisteeksi “matala” tai “korkea”. Miettikää yhdessä, mikä on tässä kokeessa järkevä matalan ja korkean raja.
Osa 2: Liukoisuus veteen
Tarvittavat välineet:
- Jokaista tutkittavaa ainetta kohden pieni puhdas dekantterilasi
- Lasisauva tai lusikka
- Vettä
Työohjeet:
Merkitse dekantterilasit, jotta tiedät missä on mitäkin ainetta.
Kaada jokaiseen dekantterilasiin vettä saman verran (noin 1-2 cm)
Laita kuhunkin dekantterilasiin lusikan kärjellinen ainetta.
Sekoita lasisauvalla ja tarkkaile aineen liukenemista. Kirjoita havaintosi ylös. Puhdista lasisauva aina siirtäessäsi eri dekantterilasiin!
Täydennä taulukko veteen liukenevuuden osalta.
HUOM! Älä kaada vesiliuoksia pois! Tarvitset niitä myös seuraavassa kokeessa.
Osa 3: Sähkönjohtavuus
Tarvittavat välineet:
- Johtokykymittari tai sähkönjohtavuuslaitteisto (paristo, ledvalo, 2 kpl elektrodeja, johtimia, hauenleukoja)
Työohjeet:
Suunnittele kuinka rakennat sähkönjohtavuuslaitteiston. Piirrä kaavio laitteistostasi ja esittele se opettajalle. Opettajan hyväksynnän jälkeen rakenna laitteisto.
Testaa vesiliuoksien sähkönjohtavuus yksitellen. Kirjaa havaintosi muistiin. Huuhtele elektrodit huolellisesti joka välissä! Jos ensimmäisellä mittauskerralla mikään liuoksista ei johda sähköä, lisää kaikkiin liuoksiin saman verran näytettä ja mittaa uudelleen.
Täydennä taulukko sähkönjohtavuuden osalta.
Tulosten käsittely:
Tulosten perusteella jaa tutkimasi aineet ioniyhdisteisiin ja molekyyliyhdisteisiin. Kirjaa nämä taulukkoon.
Jaa molekyyliyhdisteet vielä poolisiin ja poolittomiin.
Perustele millä perusteella jaottelit aineet ioniyhdisteisiin, poolisiin ja poolittomiin molekyyliyhdisteisiin. Kerro myös millaisia sidoksia näissä aineissa on.
Listaa kokeellisessa työssä esiintyneiden sidostyyppien keskeiset ominaisuudet
11.9 Tehtävät ja lisämateriaali
These are the current permissions for this document; please modify if needed. You can always modify these permissions from the manage page.