4. Muutokset elektronirakenteessa
Tässä kappaleessa käsitellään atomin elektronirakenteen muutoksia, jolloin atomi joko virittyy tai siitä tulee ioni. Kappaleeseen liittyvät tehtävät ovat omalla sivullaan. Kun koet, että osaat kappaleen asiat, voit testata osaamistasi myös monivalintatestillä.

4.1 Tavoitteet
Tavoitteena on, että tämän kappaleen jälkeen
- Osaat selittää mitä eroa on atomilla ja ionilla
- Osaat selittää miten ionit muodostuvat
- Osaat kemiallisen merkinnän perusteella kertoa, kuinka monta protonia ja neutronia elektronilla on
- Osaat kirjoittaa ionin elektronirakenteen kvanttimekaanisen atomimallin mukaisesti
- Osaat selittää mitä atomin virittyminen tarkoittaa ja osaat antaa joitakin esimerkkejä arkielämästä, joissa virittymistä tapahtuu
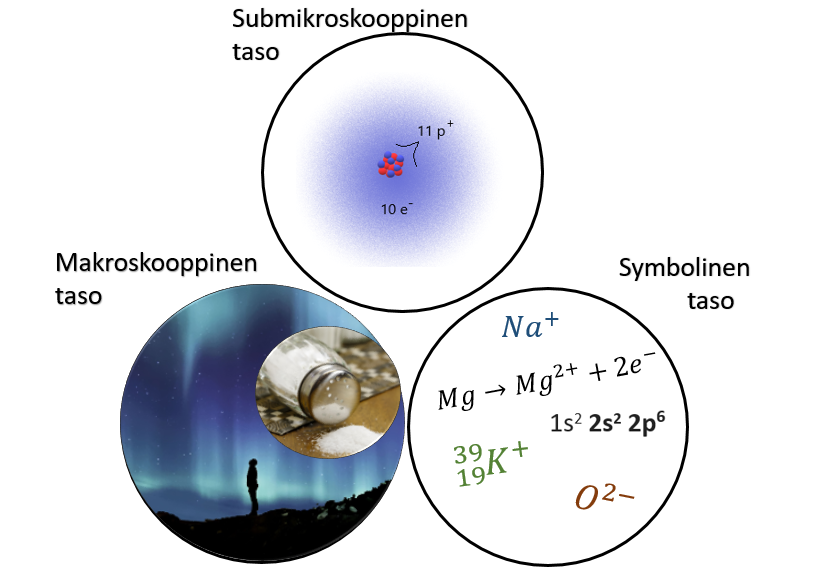
4.2 Muutokset elektronirakenteessa ja kemian kolme tasoa
Tässä kappaleessa jatkamme ilmiöiden tarkastelua submikroskooppisella tasolla. Ionit, samalla tavoin kuin atomitkin, ovat niin pieniä, ettei niitä voi havaita yksittäin.
Submikroskooppisen tason tapahtumia kuvataan yleensä symbolisen tason avulla. Symbolisella tasolla voidaan esimerkiksi kuvata, kuinka magnesiumatomista muodostuu positiivinen ioni sen luovuttaessa kaksi elektronia: . Kun tarkastelemme tällaista yhtälöä, voimme mielessämme kuvitella, kuinka submikroskooppisella tasolla magnesiumatomin elektronipilvestä poistuu kaksi elektronia ja elektronipilveen jää kaksi elektronia vähemmän kuin aiemmin.
Makroskooppisella tasolla voimme havaita monia ilmiöitä, joissa ionit ovat osallisina. Ruokaan usein lisätään ruokasuolaa eli natriumkloridia, joka on ioniyhdiste. Se tarkoittaa sitä, että NaCl:n rakenteessa - ja
-ionit vuorottelevat, muodostaen säännöllisen ionihilan eli suolakiteet, jotka pystyt näkemään.
Puhumme kappaleessa myös atomien virittymisestä, jonka makroskooppisella tasolla havaitsemme usein valona. Virittymiseen perustuvat ilotulitteiden eri värit, revontulet, neonvalot ja monet muut ilmiöt.
4.3 Mikä on ioni?
Tähän mennessä olemme puhuneet vain sähköisesti neutraaleista atomeista, joilla ei ole sähköistä varausta. Atomilla on yhtä monta positiivisia protonia ja negatiivista elektronia, joten kokonaisvaraus on nolla.
Kuten edellisessä osassa jo totesimme, protonien määrä ytimessä määrittää sen, mikä alkuaine on kyseessä. Kemiallisissa reaktioissa alkuaineet eivät muutu toisiksi alkuaineiksi, joten protonien määrä ytimessä pysyy aina samana. Atomit voivat kuitenkin joko vastaanottaa tai luovuttaa elektroneja, jolloin muodostuu varauksellinen ioni.
- Jos atomi luovuttaa yhden tai useamman elektronin: negatiivisia elektroneja on vähemmän kuin positiivisia protoneja
Muodostuu positiivinen ioni, jota kutsutaan kationiksi
- Jos atomi vastaanottaa yhden tai useamman elektronin: negatiivisia elektroneja on enemmän kuin positiivisia protoneja
Muodostuu negatiivinen ioni, jota kutsutaan anioniksi
Ionin varaus voidaan laskea aina protonien ja elektronien lukumäärän avulla:
Protonien lukumäärä - elektronien lukumäärä = ionin varaus
4.3.1 Positiivisen ionin eli kationin muodostuminen
Neutraali magnesiumatomi sisältää 12 protonia ja 12 elektronia. Usein kemiallisissa reaktioissa se kuitenkin luovuttaa kaksi elektronia ja muodostaa ionin. Tämä voidaan kuvata seuraavalla reaktioyhtälöllä:
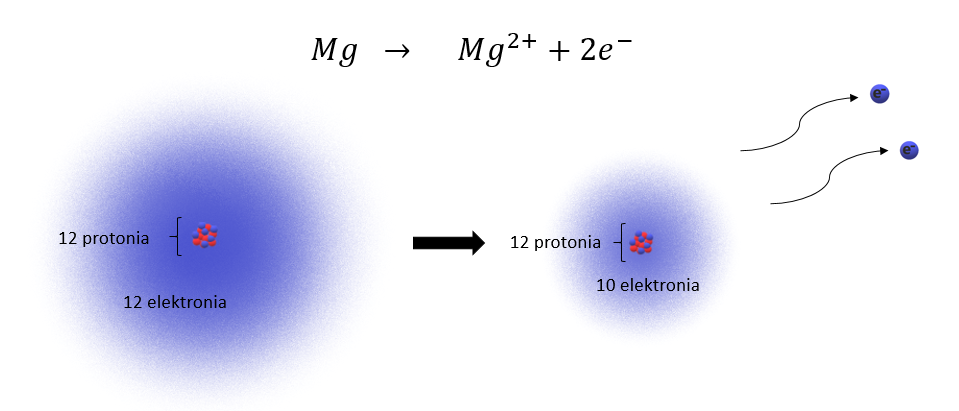
-ioni sisältää siis 12 protonia, mutta vain 10 elektronia. Magnesiumionin varaus voidaan laskea 12 – 10 = 2 eli magnesiumilla on +2 varaus. Ionin varaus ilmaistaan oikeassa yläkulmassa olevalla symbolilla.
Magnesiumionin elektronirakenne on erilainen kuin magnesiumatomin elektronirakenne. Kvanttimekaanisen atomimallin mukaan magnesiumatomin elektronirakenne on ja huomaamme, että uloimmalla kuorella eli 3. pääkuorella on 2 elektronia.
-ioni on luovuttanut kaksi elektronia, joten sen elektronirakenne voidaan kirjoittaa seuraavasti:
Magnesiumionilla on siis uloimmalla kuorella eli 2. kuorella 8 elektronia. Huomaamme, että
-ionin elektronirakenne on samanlainen kuin neonatomilla (
) ja samalla on siirrytty kuorelta n=3 kuorelle n=2.
4.3.2 Negatiivisen ionin eli anionin muodostuminen
Neutraalilla fluoriatomilla on 9 protonia ja 9 elektronia. Fluorilla on taipumuksena vastaanottaa elektroni monissa kemiallisissa reaktioissa ja se muodostaa näin negatiivisen ionin. Tätä voidaan kuvata seuraavalla reaktioyhtälöllä:
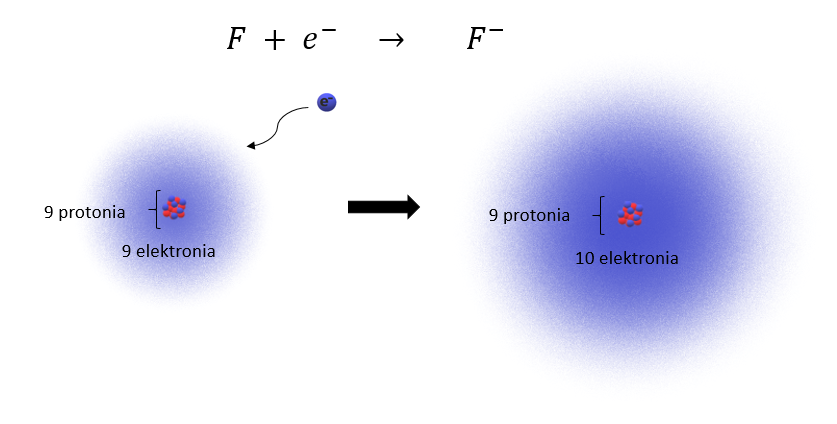
Fluori atomi saa yhden elektronin lisää, joten -ionilla on 9 protonia ja 10 elektronia, jolloin sen varaus on 9 – 10 = -1. Fluoriatomin elektronirakenne on
ja se saa yhden elektronin lisää. Fluori-ionin elektronirakenne voidaan kirjoittaa siis seuraavasti:
Huomaamme, että
-ionilla on uloimmalla kuorella eli 2. kuorella 8 elektronia ja sen elektronirakenne muistuttaa neonatomin elektronirakennetta.
4.3.3 Lisämateriaalia
4.4 Atomin virittyminen
Sähköinen vetovoima negatiivisten elektronien ja positiivisen ytimen välillä pitää atomin kasassa ja elektronit ytimen ympärillä. Kuten edellisessä kappaleessa on opittu, elektronit asettuvat aina mahdollisimman alhaisille energiatiloille eli kuorille. Mikäli elektroni saa jostain lisää energiaa, se nousee hetkellisesti kauempana ytimestä olevalle energiatilalle. Elektronin siirtymistä korkeammalle energiatilalle kutsutaan virittymiseksi.
Kuten luonnossa yleensäkin, korkealla energiatilalla olevat asiat pyrkivät siirtymään takaisin matalammille energiatiloille. Viritystilakaan ei ole stabiili ja purkautuu itsestään hetken päästä. Tällöin elektroni palaa takaisin perustilaan ja vapautuu energiatasojen erotusta vastaava energia, joka havaitaan säteilynä. Viritystilan purkautuessa joidenkin alkuaineiden atomit säteilevät näkyvää valoa niille ominaisella taajuudella. Tätä voidaan käyttää hyväksi esimerkiksi alkuaineiden tunnistuksessa.
Jos elektronin saama energian määrä on riittävän suuri, elektroni voi irrota kokonaan atomista. Tällöin elektroni ei palaa takaisin alemmalle kuorelle, vaan se poistuu atomista kokonaan. Tätä kutsutaan ionisoitumiseksi.
4.4.1 Revontulet

Tiesitkö, että revontulien kauniit värit aiheutuvat ilmakehän atomien ja molekyylien virittymisestä? Kirkkaina tanssivat revontulet johtuvat pääasiassa auringosta peräisin olevien korkeaenergisten varattujen hiukkasten törmäyksestä maapallon ilmakehän happi- ja typpiatomeihin. Maapallon magneettikentän muodon vuoksi, revontulia nähdään lähinnä pohjoisen ja eteläisen napapiirin lähettyvillä.

Revontulien alkuperä on auringossa, joka on noin 149 miljoonan kilometrin päässä maasta. Aurinkotuuleksi kutsuttu, lähinnä elektroneista ja protoneista koostuva hiukkasvirta, pakenee koronapurkauksessa auringosta avaruuteen ja osa siitä kulkeutuu kohti maata. Maapallon magneettikenttä suojaa kuitenkin meitä haitalliselta säteilyltä ja suurin osa säteilystä kiertää maan. Pieni osa varauksellisista hiukkasista joutuu magneettikenttään ja hiukkaset kulkeutuvat magneettikentän muodon takia napa-alueille.
Korkeaenergiset varatut hiukkaset törmäävät napa-alueilla maapallon ilmakehään. Ilmakehässä olevien happi- ja typpiatomien elektronit virittyvät törmäyksen energiasta ja viritystilan purkautuessa vapauttavat sähkömagneettista säteilyä, joka voidaan havaita näkyvänä valona. Revontulien väri riippuu siitä, mikä atomi virittyy ja missä korkeudessa. Vihreä valo johtuu happiatomien virittymisestä noin 120-180 kilometrin korkeudessa. Happiatomit voivat säteillä myös punaista väriä, joka useimmiten tapahtuu yli 180 kilometrin korkeudessa. Sinisen, violetin ja pinkin sävyt aiheutuvat typen elektronien virittymisestä yleensä alle 120 kilometrin korkeudessa.


4.5 Tehtävät ja lisämateriaali
Muita linkkejä opiskelun tueksi:
These are the current permissions for this document; please modify if needed. You can always modify these permissions from the manage page.