7. Konsentraatio

7.1 Tavoitteet
Tavoitteena on, että tämän kappaleen jälkeen
- Osaat selittää mitä konsentraatio tarkoittaa ja tiedät, miten se liittyy ainemäärän käsitteeseen
- Osaat muuntaa litrat millilitroiksi ja millilitrat litroiksi
- Osaat laskea konsentraation, kun ainemäärä ja tilavuus tunnetaan
- Osaat ratkaista konsentraation yhtälön myös muiden suureiden suhteen
- Osaat ratkaista useampi vaiheisia ongelmia, joissa yhdistät tietosi ainemäärästä ja konsentraatiosta
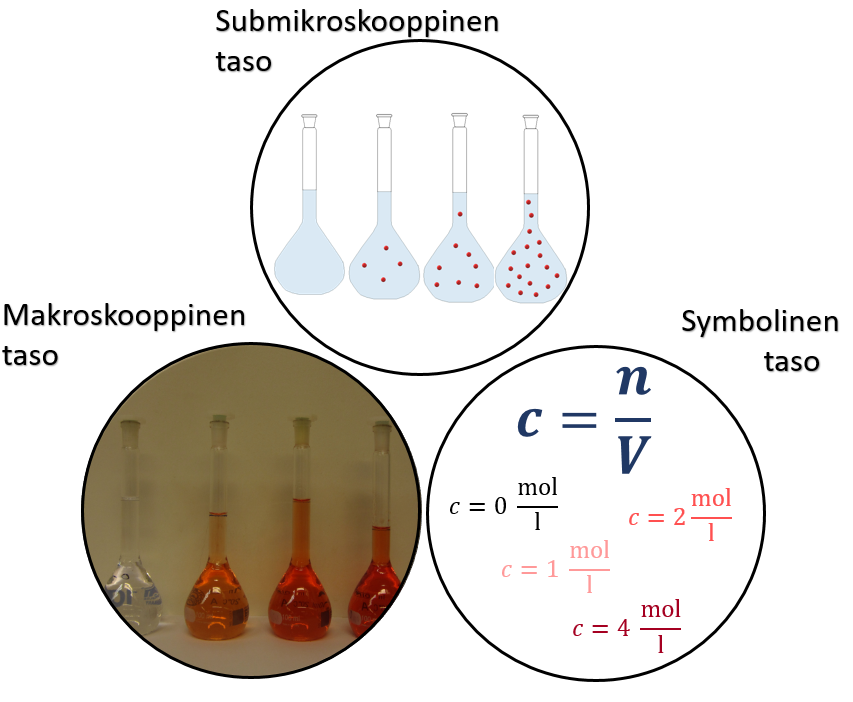
7.2 Konsentraatio ja kemian kolme tasoa
Veteen voi olla liuenneena monenlaisia ioneja ja molekyylejä. Arkielämässä olet lisännyt sokeria kahviin tai teehen tai ainakin nähnyt jonkun muun tekevän niin. Olet huomannut, että kahvia katsomalla et pysty näkemään, onko siihen lisättyä sokeria vai ei, vaikka maistamalla sen ehkä pystytkin havainnoimaan. Samalla tavoin vesijohtoveteen on liuenneena pieniä määriä erilaisia ioneja ja kivennäisaineita, joita et pysty havaitsemaan. Makroskooppisella tasolla et pysty välttämättä havaitsemaan veteen liuenneita hiukkasia tai hiukkasten määrää. Toisaalta jos veteen on liuennut värillisiä aineita, värin perusteella voit päätellä, onko ainetta siinä paljon tai vähän. Mieti esimerkiksi mehun tekemistä mehutiivisteestä. Mikäli valmistat laimeaa mehua, eli kaadat vain pienen määrän tiivistettä ja loput vettä, on värikin haalea. Mikäli laitat suuren määrän tiivistettä ja vähemmän vettä, tulee mehusta voimakkaan väristä.
Submikroskooppisella tasolla eli atomien ja molekyylien tasolla, voidaan tarkastella hiukkasten lukumäärää liuoksessa. Mitä enemmän hiukkasia on liuoksessa, sen suurempi on konsentraatio. Edellisessä kappaleessa opit ainemäärän käsitteen, joka kuvaa aineen perusosasten lukumäärää. Konsentraatio kuvaa liuokseen liuenneen aineen ainemäärää. Symbolisella tasolla konsentraatio (c) saadaan jakamalla liuokseen liuennut ainemäärä (n) liuoksen tilavuudella (V).
7.3 Veden laatu
Juomaveden puhtaus on yksi tärkeimmistä tekijöistä terveytemme kannalta. Kaupungeissa juomavesi tulee yleensä putkia pitkin kotiimme vedenpuhdistamon kautta, jossa veden laatua seurataan jatkuvasti. Jos juomavesi tulee omasta kaivosta, tulisi silloinkin veden laatu tutkituttaa säännöllisesti. Veteen liuenneena voi olla paljon sellaisia aineita, joita ei juodessaan huomaa. Osa näistä aineista voi olla vahingollisia terveydelle, mikäli vettä juo säännöllisesti ja aineen pitoisuus vedessä on suuri. Katso esimerkiksi Ylen artikkeli Yhdysvaltalaisen Beevillen kaupungin vedestä.
Veden laatua verrataan suositusarvoihin. Suositusarvot ja näytteet ilmaistaan usein yksikössä (millimoolia per litra),
(milligrammaa per litra) tai
(mikrogrammaa per litra).
Tarkastellaan seuraavaa kaivoveden analyysiä:
Mittaustulokset on annettu keskellä ja suositukset oikeassa reunassa.
Veden kovuus eli kalsiumin ja magnesiumin määrä vedessä ilmoitetaan yleensä joko saksalaisina asteina (°dH) tai millimooleina litrassa (). Edellisessä kappaleessa tutustuimme ainemäärän käsitteeseen ja ainemäärän yksikköön mooliin. Millimooli on moolin tuhannesosa. Kun veden kovuus ilmoitetaan yksikössä
, tarkastellaan siis Ca- ja Mg-ionien lukumäärää yhdessä litrassa vettä. Mitä enemmän vedessä on kalsiumia ja magnesiumia, sitä kovempaa vesi on. Veden kovuus vaikuttaa esimerkiksi siihen, kuinka paljon pesuainetta suositellaan käytettävän pyykinpesussa.
7.3.1 Lisätietoa
7.4 Konsentraatio
Monet kemialliset reaktiot tapahtuvat vesiliuoksissa, johon on liuenneena kiinteää ainetta, nestettä tai kaasua. Liuos on homogeeninen seos, joten liuenneen aineen perusyksiköt ovat tasaisesti kaikkialla liuoksessa.
Esimerkiksi ruokasuola (NaCl) liukenee veteen ioneina. Tämä tarkoittaa sitä, että - ja
-ionit ovat jakautuneet tasaisesti kaikkialle liuokseen.

Liuoksia on yleensä helpointa mitata tilavuuden avulla. Tilavuuden mittaamisessa voidaan käyttää apuna esimerkiksi mittapulloa, mittalasia, mittapipettiä tai täyspipettiä.
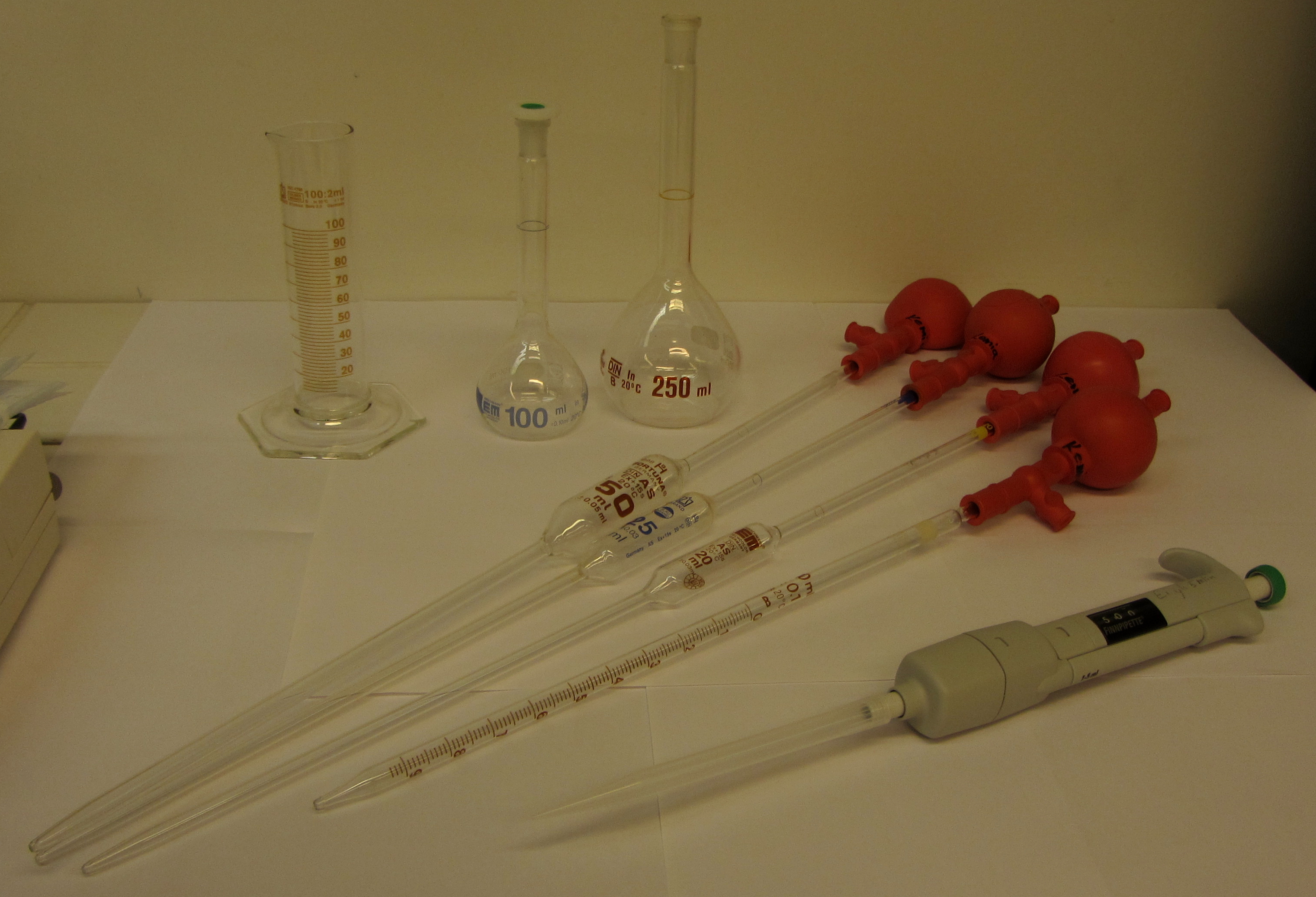
Konsentraatio kertoo, kuinka suuri ainemäärä liuennutta ainetta on yhdessä litrassa liuotinta. Mitä suurempi konsentraatio, sen enemmän liuoksessa on liuennutta ainetta.
- Jos yhteen litraan vettä on liuennut 1 mooli ruokasuolaa, on liuoksen konsentraatio 1
- Jos yhteen litraan vettä on liuennut 2 moolia ruokasuolaa, on liuoksen konsentraatio 2
Liuoksen konsentraatio voidaan laskea seuraavan yhtälön avulla:
= konsentraatio, jonka yksikkö on moolia per litra (
)
= liuenneen aineen ainemäärä, jonka yksikkö on mooli (mol)
= liuoksen tilavuus, jonka yksikkö on litra (l)
Tiesitkö, että yksi litra on yhtä suuri kuin yksi kuutiodesimetri eli ? Tässä kappaleessa käytämme tilavuuden yksikkönä litraa, mutta muissa yhteyksissä saatat törmätä siihen, että tilavuus ilmoitetaan kuutiodesimetreinä.
Jos liuennut aine on värillinen, liuenneen aineen määrä vaikuttaa myös liuoksen väriin. Tarkastellaan seuraavaa kuvaa, jossa on rautakelaattia happamaan vesiliuokseen liuenneena. Värin perusteella voit helposti päätellä, kummassa reunassa on konsentraatioltaan pienin liuos ja kummassa reunassa konsentraatioltaan suurin liuos.

Esimerkki
Pitävää hiuslakkaa voi valmistaa itse liuottamalla sokeria (sakkaroosi, M = 342,3 ) kuumaan veteen. Jäähtymisen jälkeen liuos siirretään suihkepulloon ja sitä voi käyttää tavallisen hiuslakan tapaan. Liuokseen voi halutessaan lisätä eteeristä öljyä tuoksuksi. Liuoksen konsentraatiota muuttamalla voi vaikuttaa hiuslakan ominaisuuksiin.
Mikä on sokerin konsentraatio hiuslakassa, jos 250 millilitraan vettä on lisätty 25 g sokeria?
Vastaus
Listataan ensin, mitä tiedetään:
- Tehtävänannossa on kerrottu liuoksen tilavuus. Muutetaan tilavuus litroiksi.
- Tehtävänannossa on kerrottu sokerin massa, m = 25 g
- Tehtävänannossa on kerrottu sokerin moolimassa, M = 342,3
Tehtävässä kysyttiin sokerin konsentraatiota liuoksessa, joten käytetään seuraavaa yhtälöä:
Huomataan, että kaavassa tarvitaan ainemäärää (n) ja tiedossa on vain massa (m). Lasketaan ensin ainemäärä
Nyt voidaan sijoittaa arvot konsentraation lausekkeeseen
Vastaukseksi saadaan, että sokerin konsentraatio liuoksessa on 0,29 .
Esimerkki
Sinun tulisi laboratoriossa valmistaa kuparinitraattiliuos (), jonka konsentraatio on 0,2
. Valmista liuosta tarvitaan 100 ml. Kuinka paljon sinun tulee punnita kiinteä kuparinitraattia (M= 187,56
)?

Vastaus
Listataan ensin, mitä tiedetään:
- Tehtävänannossa on kerrottu valmiin liuoksen tilavuus. Muutetaan tilavuus litroiksi.
- Tehtävänannossa on kerrottu kuparinitraattiliuoksen konsentraatio, c = 0,2
.
- Tehtävänannossa on annettu kuparinitraatin moolimassa (M= 187,56
)
Tehtävässä kysytään, kuinka paljon kuparinitraattia tulee punnita, jotta valmistettavan liuoksen konsentraatioksi saadaan 0,2 . Lasketaan ensin, kuinka suuri ainemäärä kuparinitraattia tarvitaan halutun konsentraation saavuttamiseksi ja käytetään siihen seuraavaa kaavaa:
Ainemäärä (n) on se suure, jonka haluamme selvittää. Ratkaistaan yhtälö ainemäärän suhteen kertomalla molemmat puolet tilavuudella.
Yhtälön oikealla puolella on tilavuus sekä osoittajassa että nimittäjässä, joten ne voidaan supistaa pois ja saadaan yhtälö:
Nyt voidaan sijoittaa lukuarvot yhtälöön:
Eli kuparinitraattia tarvitaan 0,02 mol. Huomataan kuitenkin, että ainemäärää ei pystytä punnitsemaan, vaan sen avulla täytyy laskea massa. Käytetään ainemäärään kaavaa:
Ainemäärä tunnetaan ja moolimassa tunnetaan. Ratkaistaan yhtälö massan suhteen kertomalla molemmat puolet moolimassalla (M). Tuloksena saadaan:
Sijoitetaan lukuarvot yhtälöön:
Tulokseksi saatiin, että kuparinitraattia tulee punnita 3,75 g.
7.5 Konsentraation tutkiminen simulaation avulla
Tutkitaan konsentraatiota simulaation avulla.
1. Tutustu ensin simulaation ominaisuuksiin kokeilemalla:
- Kokeile mistä saat lisättyä puhdasta vettä
- Mistä pystyt valuttamaan liuosta pois
- Kuinka konsentraatiomittari toimii
- Kuinka lisäät liuokseen ainetta ja tutustu mitä aineita voit lisätä
- Mitä tapahtuu, kun säädät haihtumista
2. Valmista puoli litraa kuparisulfaattiliuosta (), jonka konsentraatio on noin 0,5
. Kirjoita tarkka konsentraatio ylös
3. Mitä tapahtuu konsentraatiolle, kun lisäät puhdasta vettä astian täyteen?
Mikä on nyt konsentraatio?
Valitse alla olevista kuvista (A, B, C) sopivin kuvaamaan muutosta molekyylitasolla:
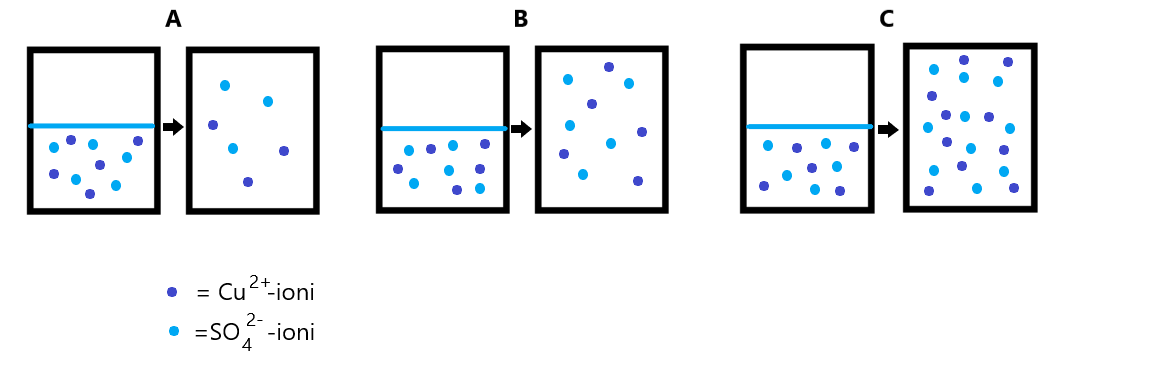
Selitä omin sanoin, mitä tapahtuu molekyylitasolla lisätessäsi puhdasta vettä liuokseen
4. Valuta liuosta pois poistohanan kautta, kunnes sitä on jäljellä taas puoli litraa.
Mikä on nyt konsentraatio?
Selitä omin sanoin, mitä tapahtuu molekyylitasolla valuttaessasi liuosta pois.
Selitä miksi liuoksen konsentraatio pysyi samana.
5. Valmista puoli litraa kuparisulfaattiliuosta, jonka konsentraatio on noin 1,0 . Kirjoita tarkka konsentraatio ylös.
6. Ennusta mikä on liuoksen konsentraatio, jos lisäät liuokseen vettä niin, että astia tulee täyteen. Kirjoita ennustuksesi muistiin.
7. Lisää liuokseen vettä niin, että astia tulee täyteen.
Mikä on nyt konsentraatio?
Osuiko ennustuksesi oikeaan? Mikäli ei osunut, pohdi mikä meni pieleen.
8. Haihduta astiasta vettä, kunnes liuosta on jäljellä puoli litraa.
Mikä on nyt konsentraatio?
Miksi konsentraatio muuttui haihduttaessa, eikä säilynyt samana niin kuin liuosta pois valuttaessa? Selitä omin sanoin, mitä tapahtuu molekyylitasolla haihdutuksessa.
9. Haihduta kaikki vesi astiasta. Mitä tapahtuu?
Apukappale
These are the current permissions for this document; please modify if needed. You can always modify these permissions from the manage page.
