9. Heikot sidokset
Tässä kappaleessa tutustutaan molekyylien välisiin sidoksiin - eli heikkoihin sidoksiin.
Kappaleeseen liittyvät tehtävät löytyvät omalta sivultaan. Kun koet, että osaat kappaleen asiat, voit testata osaamistasi myös monivalintatestillä.

9.1 Tavoitteet
Tavoitteena on, että tämän kappaleen jälkeen
- Osaat kuvailla mitä eroa on vahvoilla ja heikoilla sidoksilla
- Osaat sidosten poolisuuden ja avaruudellisen rakenteen perusteella kertoa, onko molekyyli poolinen vai pooliton
- Osaat selittää mitä dipoli-dipolisidoksella tarkoitetaan ja tiedät, millaisten molekyylien välille se syntyy
- Osaat selittää mitä vetysidoksella tarkoitetaan ja tiedät, millaisten molekyylien välille se syntyy
- Osaat nimetä joitakin elämälle tärkeitä aineita, joissa vetysidoksia esiintyy
- Osaat selittää mitä dispersiovoimilla tarkoitetaan ja tiedät, millaisten molekyylien välille se syntyy
- Osaat selittää, millä tavalla molekyyliyhdisteen kiinteän, nestemäisen ja kaasumaisen olomuodon molekyylien väliset sidokset eroavat. Osaat myös piirtämällä kuvata näitä eroja.
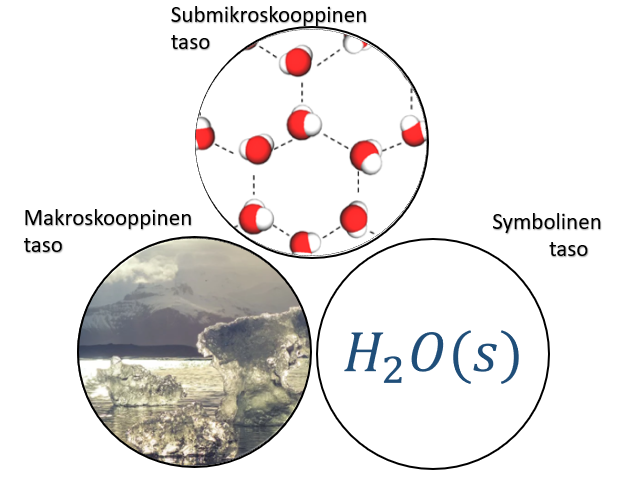
9.2 Heikot sidokset ja kemian kolme tasoa
Kovalenttiset sidokset sitovat atomeja yhteen muodostaen erilaisia molekyylejä, kuten esimerkiksi vesimolekyylejä tai sokerimolekyylejä. Sokerimolekyylissä on jo kymmenittäin atomeja yhteen liittyneenä. Vaikka sokerimolekyyli on isompi kuin vesimolekyyli, on se kuitenkin niin pieni, ettemme pysty sitä näkemään makroskooppisella tasolla.
Jos molekyylien välillä ei olisi minkäänlaisia sidoksia, molekyyliyhdisteet esiintyisivät vain kaasumuodossa ja hajaantuisivat kaikkialle ympäristöön. Tiedämme kuitenkin, että sokeri on huoneenlämmössä kiinteää ainetta ja vesi nestemäistä. Molekyylien välillä on siis oltava sidoksia, jotka saavat aineen pysymään kasassa.
Molekyylien välisiä vetovoimia kutsutaan heikoiksi sidoksiksi ja ne antavat submikroskooppisen tason selityksen sille, miksi moni molekyyliyhdiste esiintyy useammassa olomuodossa. Submikroskooppisella tasolla molekyylien välisiä heikkoja sidoksia voidaan tarkastella molekyylimallien avulla.
Tavoitteena on, että nähdessäsi symbolisen tason esityksen, esimerkiksi , pystyt heti mielessäsi kuvittelemaan, miltä se näyttää makroskooppisella ja symbolisella tasolla.
9.3 Heikot sidokset – Molekyylien väliset sidokset
Edellisessä kappaleessa käsittelimme vahvoja sidoksia, jotka sitovat atomeja ja ioneja yhteen. Vahvojen sidoksien avulla voi muodostua isoja rakenteita, kuten esimerkiksi ionihila ja metallihila. Edellisessä kappaleessa myös tarkastelimme, kuinka atomeista muodostuu molekyylejä kovalenttisten sidosten avulla. Yksittäinen molekyyli on kuitenkin vielä submikroskooppisen pieni kooltaan. Kuinka näistä pienen pienistä yksittäisistä molekyyleistä voi muodostua aine, jonka näemme?
Jos molekyylien välillä ei olisi minkäänlaisia vuorovaikutuksia, ne eivät pysyisi yhdessä, vaan hajaantuisivat kaikkialle ympäristöön ja yhä kauemmas toisistaan. Näin tapahtuukin kaasumaisessa olomuodossa, jossa molekyylien välillä ei ole juurikaan vuorovaikutusta.
Nestemäisessä ja kiinteässä olomuodossa molekyylien välillä on heikoiksi sidoksiksi kutsuttuja sähköisiä vetovoimia. Niitä kutsutaan heikoiksi, koska ne ovat selvästi heikompia kuin atomien ja ionien väliset vahvat sidokset.
Heikkoja sidoksia ovat dipoli-dipolisidos, vetysidos ja dispersiovoimat. Molekyylin poolisuus vaikuttaa merkittävästi siihen, millaisia sidoksia molekyylien välille muodostuu.
9.4 Molekyylin poolisuus
Poolisuudella tarkoitetaan elektronien epätasaista jakautumista molekyylissä, jolloin molekyyliin muodostuu elektronirikkaita (negatiivinen osittaisvaraus) ja elektroniköyhiä alueita (positiivinen osittaisvaraus). Molekyylin poolisuutta tarkastellessa pitää huomioida kaksi asiaa:
- Onko molekyylissä poolisia sidoksia?
- Kumoaako molekyylin symmetrinen muoto varaukset?
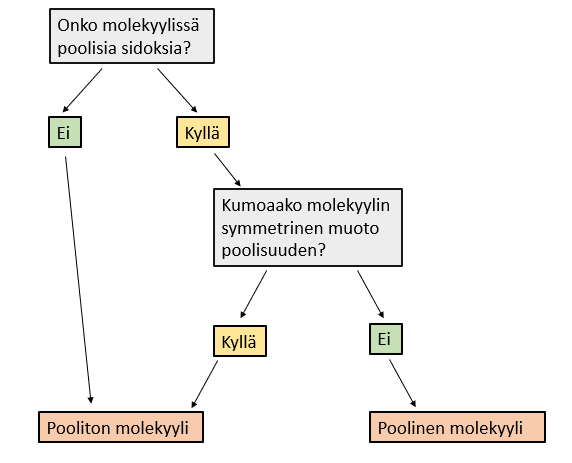
Pooliset molekyylit ovat dipoleja. Tämä tarkoittaa sitä, että molekyylillä on pysyvät sähköiset navat, jotka ovat sähkövaraukseltaan yhtä suuria, mutta erimerkkisiä.
9.4.1 Sidoksen poolisuus
Poolisia sidoksia tarkasteltiin edellisessä kappaleessa. Mitä suurempi elektronegatiivisuusero kahden kovalenttisesti toisiinsa sitoutuneen atomin välillä on, sitä poolisempi sidos on. Jos elektronegatiivisuusero on riittävän suuri, ei puhuta enää poolisesta kovalenttisesta sidoksesta, vaan ionisidoksesta.
Tarkatellaan esimerkiksi hapen ja vedyn välistä sidosta.
- Hapen elektronegatiivisuus on 3,5
- Vedyn elektronegatiivisuus on 2,1
- Elektronegatiivisuusero saadaan vähentämällä pienempi elektronegatiivisuus suuremmasta, eli 3,5-2,1=1,4.
Hapen ja vedyn välinen sidos on poolinen
Vertailun vuoksi lasketaan hiilen ja vedyn välinen elektronegatiivisuusero.
- Hiilen elektronegatiivisuus on 2,5
- Vedyn elektronegatiivisuus on 2,1
- Elektronegatiivisuusero 2,5-2,1=0,4
Hiilen ja vedyn elektronegatiivisuudet lähellä toisiaan (elektronegatiivisuusero 0,5 tai alle), joten sidos on vain heikosti poolinen.
Täysin poolittomia sidoksia syntyy kahden saman alkuaineen atomin välille, kuten esimerkiksi happimolekyyli . Jos kaikki molekyylin sidokset ovat poolittomia, on myös molekyyli pooliton.

9.4.2 Molekyylin muoto
Molekyylit koostuvat useammista atomeista, jotka ovat liittyneet yhteen kovalenttisilla sidoksilla. Vaikka molekyylissä on poolisia sidoksia, ei se välttämättä tarkoita, että molekyyli on poolinen.
Verrataan vesimolekyyliä ja hiilidioksidimolekyyliä toisiinsa. Vaikka vesimolekyylissä () ja hiilidioksidimolekyylissä (
) on molemmissa kolme atomia, ne ovat muodoltaan erilaiset.
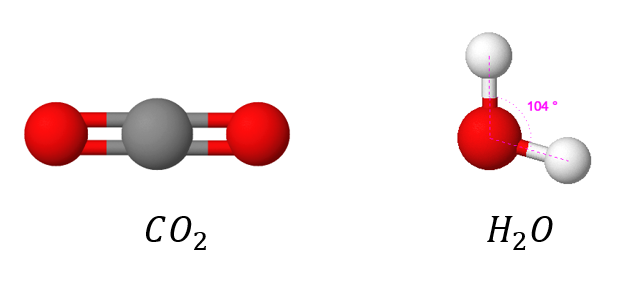
Vesimolekyylissä vetyjen välinen kulma on 104,5°, joka tekee molekyylin aina tietyn muotoiseksi. Hiilidioksidimolekyyli on taas muodoltaan lineaarinen. Vedyn ja hapen sekä hiilen ja hapen sidokset ovat molemmat poolisia, mutta miksi vain vesi on poolinen molekyyli?
Hiilidioksidimolekyylin poolittomuus johtuu sen muodosta. Happiatomit ovat vastakkaisilla puolilla hiiliatomia, joten ne kumoavat toistensa osittaisvaraukset.
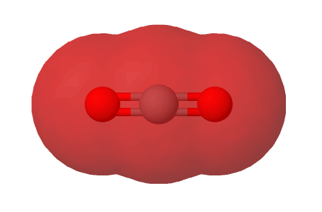
Vertaa hiilidioksidimolekyyliä vesimolekyyliin, jossa vetyatomit ovat samalla puolella happiatomia.
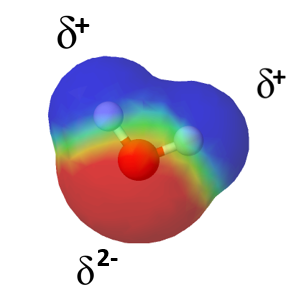
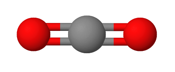
Molekyylin poolisuutta tarkastellessa, pitää aina tarkastella myös molekyylin avaruudellista muotoa. Symmetrisiä muotoja, joissa sidosten poolisuus kumoutuu ovat esimerkiksi seuraavat:
- Lineaarinen molekyyli, jossa kaksi samanlaista sidosta
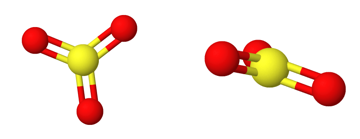
- Tasomainen molekyyli, jossa kolme samanlaista sidosta
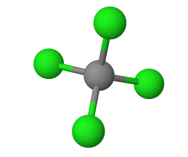
- Tetraedrin muotoinen molekyyli, jossa neljä samanlaista sidosta
9.5 Molekyylin poolisuuden tutkiminen molekyylimallinnuksen avulla
Molekyylin poolisuutta voi tutkia myös molekyylimallinnusohjelmien avulla. Tässä materiaalissa mallinnukseen on käytetty MolView-ohjelmaa, joka toimii selaimessa, joten sen käyttäminen ei vaadi ohjelman asennusta tietokoneelle.
Ylioppilaskirjoituksissa käytössä on MarvinSketch-ohjelma. Jos haluat aloittaa MarvinSketchin käytön harjoittelun jo nyt, kaikki mallinnustehtävät on mahdollista tehdä myös sen avulla.
9.6 Dipoli-dipolisidos
Dipoli-dipolisidokset, kuten kaikki muutkin sidokset, perustuvat sähköiseen vetovoimaan. Poolisten molekyylien välille syntyy dipoli-dipolisidoksia, kun molekyylin positiivinen osittaisvaraus vetää viereisen molekyylin negatiivista osittaisvarausta puoleensa. Dipoli-dipolisidos syntyy siis kahden poolisen molekyylin erimerkkisten päiden välille. Alla olevassa kuvassa on esitetty kaksi asetonimolekyyliä, joiden välistä dipoli-dipolisidosta kuvataan katkoviivalla.
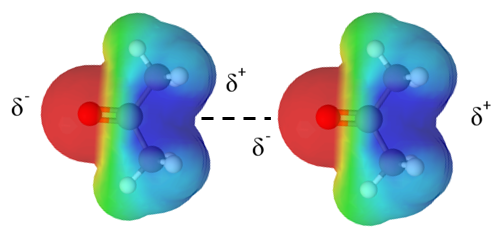
Huom! Dipoli-dipolisidoksia syntyy vain poolisten molekyylien välille!
9.7 Vetysidos
Vetysidos on oikeastaan dipoli-dipolisidoksen erikoistapaus. Vetysidos on tavallista dipoli-dipolisidosta vahvempi sidos, mutta se ei ole kuitenkaan niin vahva kuin vahvat sidokset (molekyylien sisäiset sidokset). Vetysidos muodostuu elektronegatiiviseen happeen (O), typpeen (N) tai fluoriin (F) sitoutuneen vedyn ja toisessa molekyylissä olevan hapen, typen tai fluorin välille.
Vetysidos voi muodostua siis seuraavien viereisissä molekyyleissä olevien atomien välille (isoissa molekyyleissä voivat olla myös samassa molekyylissä):
....
....
....
Koska vety on sitoutunut elektronegatiiviseen atomiin, on sillä positiivinen osittaisvaraus. Tästä syystä vedyn ja viereisen molekyylin elektronegatiivisen atomin välille syntyy puoleensa vetävä vuorovaikutus. Vetysidoksia kuvataan yleensä katkoviivalla.
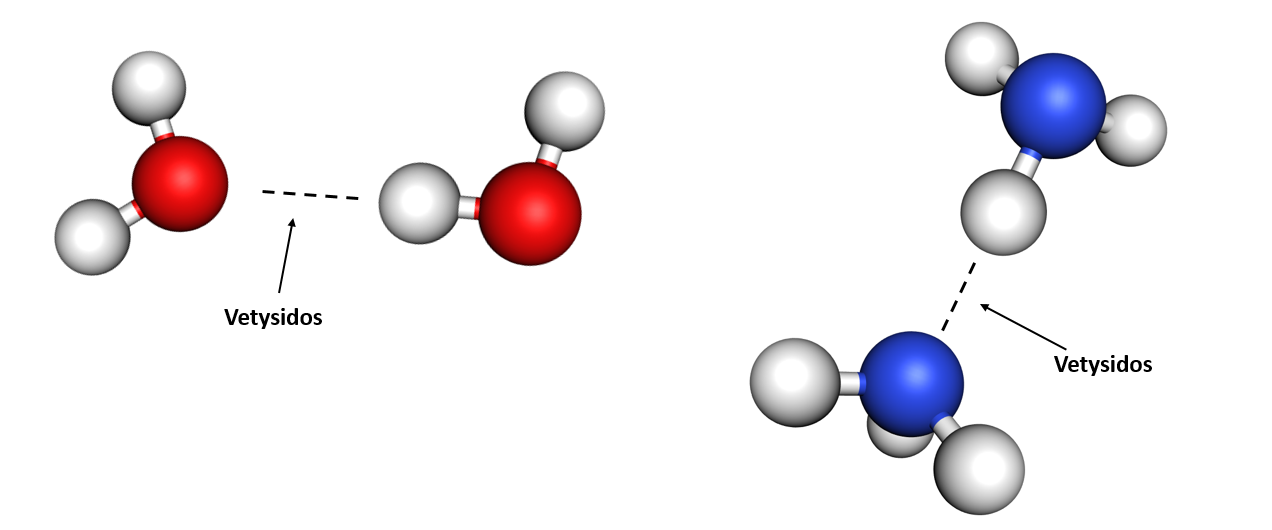
Vetysidos on erityisen merkittävä siksi, että se antaa monille elämälle tärkeille aineille niiden erityisominaisuudet. Vetysidos esimerkiksi antaa vedelle sen ainutlaatuiset ominaisuudet.
Myös eliöiden perinnöllisen koodin määrittävän DNA-molekyylin puoliskot kiinnittyvät toisiinsa vetysidosten avulla. DNA-molekyyli koostuu kahdesta kierteestä, joihin on kiinnittynyt emäksiä tietyssä järjestyksessä. Emästen järjestys määrittää yksilön geneettisen koodin. DNA-molekyylin emäksiä ovat adeniini (A), guaniini (G), sytosiini (C) ja tymiini (T). Vastakkaisten juosteiden emäkset sitoutuvat vetysidoksilla toisiinsa, kuten alla olevassa kuvassa guaniini ja sytosiini.
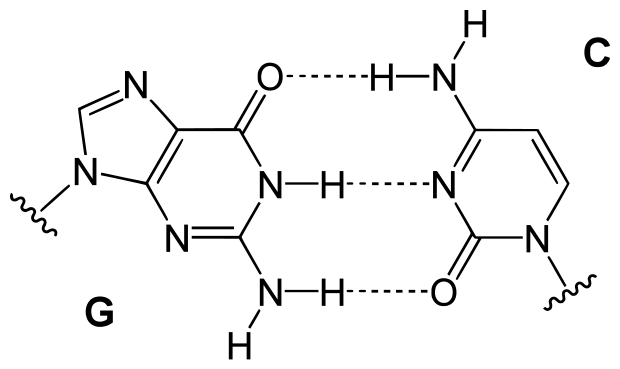

9.8 Dispersiovoimat
Dispersiovoimia esiintyy kaikissa molekyyliyhdisteissä. Ne johtuvat hetkellisten positiivisten ja negatiivisten sähkövarausten vetovoimasta.
Poolittomassa molekyylissä elektronijakauma voi olla hetkellisesti epätasaisesti jakautunut, kun jatkuvasti liikkuvat elektronit ovat hetkellisesti lähempänä toisen atomin ydintä. Tällöin syntyy hetkellinen osittaisvaraus.
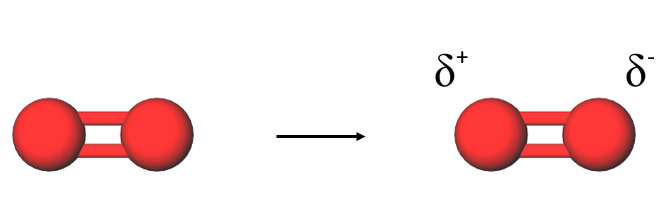
Hetkellisen osittaisvarauksen syntyminen yhteen molekyyliin aiheuttaa ketjureaktion eli viereisissä molekyyleissä syntyy vastaavanlainen osittaisvaraus ja molekyylit vetävät toisiaan puoleensa.
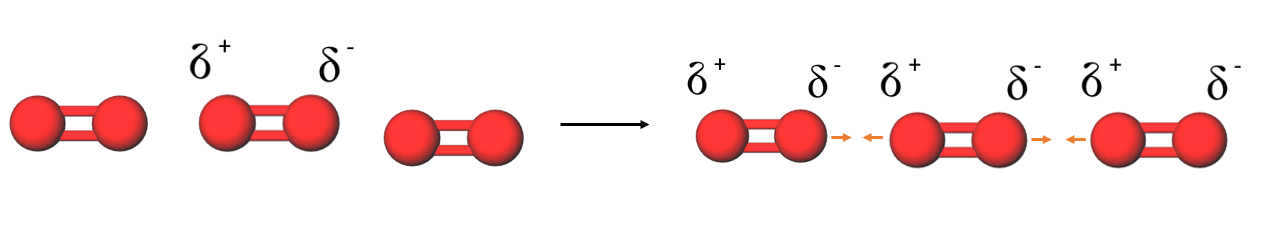
Poolittomissa molekyyleissä dispersiovoimat ovat ainoita voimia, jotka sitovat molekyylejä toisiinsa. Dispersiovoimat ovat kaikkein heikoimpia sidoksia ja niiden katkaisemiseen ei tarvita paljon energiaa. Tästä syystä poolittomilla molekyyliyhdisteillä on usein matalat sulamis- ja kiehumispisteet.
Dispersiovoimia syntyy kaikissa molekyyliyhdisteissä, mutta ainoita molekyylien välisiä sidoksia ne ovat poolittomilla molekyyleillä.
9.9 Heikot sidokset ja olomuodot
Kiinteässä olomuodossa molekyylien väliset sidokset estävät niitä liikkumasta toistensa ohitse. Molekyylit eivät kuitenkaan ole täysin pysähdyksissä, vaan ne värähtelevät koko ajan paikoillaan. Kiinteässä olomuodossa myös molekyylit muodostavat säännöllisiä hilarakenteita, jossa molekyylit sitoutuvat toisiinsa heikkojen sidosten avulla. Molekyyleistä muodostuvaa hilaa kutsutaankin molekyylihilaksi. Huomaa kuitenkin, että molekyylihilaa yhdessä pitävät heikot sidokset katkeavat huomattavasti helpommin kuin ionihilan ionisidokset tai metallihilan metallisidokset.
Nestemäisessä olomuodossa molekyylit pääsevät liikkumaan toistensa lomitse ja pystyvät mukautumaan astian muotoon. Nestemäisessä olomuodossa molekyylit ovat jatkuvassa liikkeessä, mutta molekyylien väliset heikot sidokset vetävät toisiaan puoleensa.
Kaasumaisessa olomuodossa molekyylit pääsevät liikkumaan täysin vapaasti. Molekyylit liikkuvat niin nopeasti ja ne ovat niin kaukana toisistaan, ettei niiden välille synny sidoksia. Kaasumaisessa olomuodossa molekyylit pääsevät hajaantumaan kauaksi toisistaan.
Olomuodon muutoksissa molekyylien väliset heikot sidokset katkeavat tai uusia heikkoja sidoksia muodostuu molekyylien välille. Huomaa, että olomuodon muutoksissa molekyylin sisäiset kovalenttiset sidokset kuitenkin säilyvät muuttumattomina. Aine ei siis muutu toiseksi aineeksi, pelkästään olomuoto muuttuu.
9.10 Tehtävät ja lisämateriaali
Muita linkkejä opiskelun tueksi:
apukappale
These are the current permissions for this document; please modify if needed. You can always modify these permissions from the manage page.