3. Atomin rakenne
Tässä kappaleessa sukelletaan submikroskooppiselle tasolle atomien mielenkiintoiseen maailmaan. Kappaleeseen liittyvät tehtävät ovat omalla sivullaan. Kun koet, että osaat kappaleen asiat, voit testata osaamistasi myös monivalintatestillä.

3.1 Tavoitteet
Tavoitteena on, että tämän kappaleen jälkeen
- Osaat kuvailla pääpiirteittäin, kuinka nykyisin tuntemamme atomimalli on kehittynyt
- Tunnet atomin perusrakenteen ja osaat nimetä atomin osat: ydin, elektronipilvi, protoni, neutroni ja elektroni
- Osaat selittää, mikä tekee atomista juuri tietyn alkuaineen atomin
- Tiedät mitä isotooppi tarkoittaa ja millä tavalla saman aineen isotoopit eroavat toisistaan
- Tiedät mitä massaluku ja järjestysluku tarkoittavat
- Osaat isotooppimerkinnän perusteella kertoa, kuinka monta elektronia, protonia ja neutronia atomilla on
- Osaat nimetä eroavaisuuksia Bohrin atomimallin ja kvanttimekaanisen atomimallin välillä
- Osaat selittää pääpiirteittäin, mitä tarkoittaa energian kvantittuminen ja minimienergiaperiaate
- Osaat kuvailla mitä kvanttimekaanisessa atomimallissa pääkuoret, alikuoret ja orbitaalit tarkoittavat
- Osaat kirjoittaa atomin elektronirakenteen kvanttimekaanisen mallin mukaisesti
- Osaat päätellä kvanttimekaanisen mallin mukaisesti kirjoitetusta elektronirakenteesta atomin ulkoelektronien lukumäärän
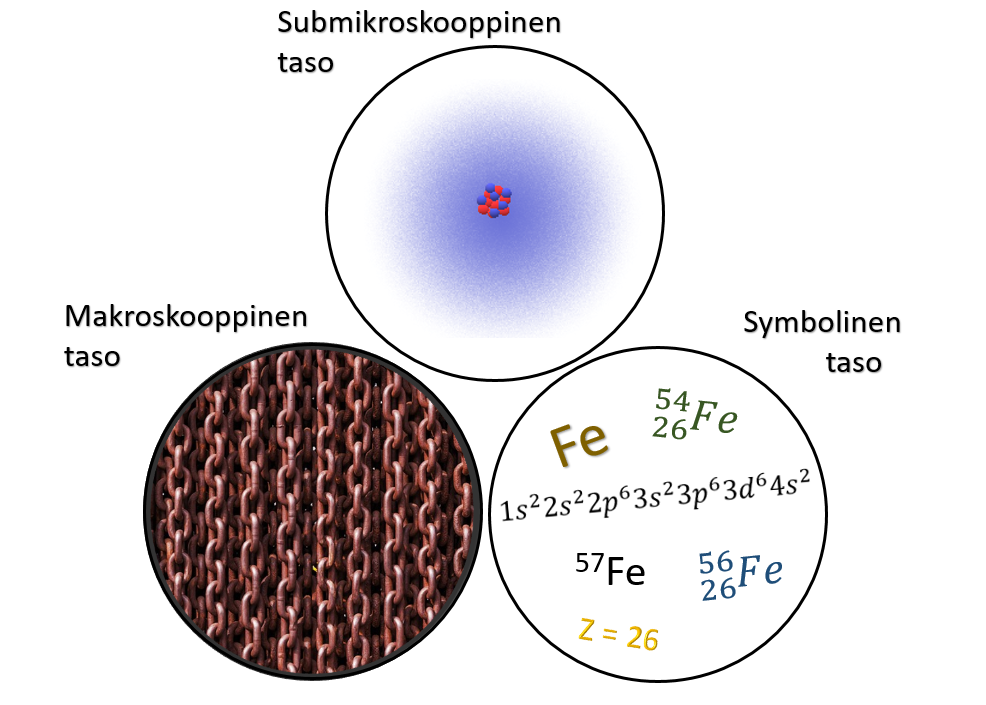
3.2 Atomi ja kemian kolme tasoa
Atomi voi tuntua kaukaiselta käsitteeltä, vaikka niitä on joka puolella ympärillämme. Näyttö, jolta tätä tekstiä luet, koostuu atomeista ja hengittämäsi ilma koostuu atomeista. Vaikka edessäsi oleva pöytä näyttää silmääsi jatkuvalta, se koostuu atomeista, joista suurin osa on tyhjää tilaa. Arkipäiväisissä tilanteissa emme pysty havaitsemaan yksittäistä atomia, joten aluksi voi tuntua oudolta ajatella, että kaikki todellakin koostuu atomeista.
Makroskooppisella tasolla emme pysty havainnoimaan atomeja, sillä ne ovat siihen aivan liian pieniä. Toisaalta kemiassa melkein kaikkien makroskooppisen tason ilmiöiden, joita voimme aistein havaita, selittämiseen tarvitaan submikroskooppisen tason eli atomi- ja molekyylitason tietoa. Vaikka ilmiöt havaitaan makroskooppisella tasolla, ilmiöiden ymmärtäminen vaatii submikroskooppisen tason tietoa.
Symbolisella tasolla esimerkiksi raudan elektronirakennetta voidaan kuvata seuraavasti . Rautaa voidaan kuvata kemiallisella merkillä
ja tilanteesta riippuen, sillä tarkoitetaan joko yksittäistä rauta-atomia tai isompaa kimpaletta rautametallia. Tässä kappaleessa alkuaineen symbolilla viitataan useimmiten yksittäiseen atomiin.
Atomiteorian voi katsoa olevan kemian oppimisen kivijalka – lähes kaikkien kemiallisten ilmiöiden syvälliseen ymmärtämiseen tarvitaan tietämystä atomien rakenteesta ja erityisesti atomien elektronirakenteesta.
3.3 Atomimallien historia
Antiikin aikoina ajateltiin, että maailma koostuu neljästä eri aineesta: maasta, tulesta, ilmasta ja vedestä. Nykyään tiedämme, että tämä on virheellinen käsitys. Noin 400 vuotta ennen ajanlaskun alkua kaksi kreikkalaista filosofia, Leucippus ja Democritus, keksivät atomiteorian. He julistivat kaiken koostuvan jakamattomista osasista, jotka he nimesivät atomeiksi (kreikan sana atomon tarkoittaa jakamatonta).
Ensimmäinen atomiteoria jäi unholaan yli kahden tuhannen vuoden ajaksi ja vasta 1800-luvun alussa tieteilijät palasivat atomiteorian pariin. Atomi on kuitenkin niin pieni, ettei sitä pystytä näkemään edes mikroskoopin avulla. Tieteilijät ovatkin kokeellisten tutkimusten perusteella rakentaneet toimivan mallin atomin rakenteesta. Useita erilaisia atomimalleja on kehitetty viimeisen sadan vuoden aikana. Tieteilijät ovat käyttäneet paljon aikaa mallien rakentamiseen, testaamiseen ja kehittämiseen. Mallit ovat hyödyllisiä, koska ne auttavat meitä selittämään havaintoja. Malleja ei kuitenkaan pidä ottaa totena: ne ovat nimensä mukaisesti vain malleja, joiden avulla pystymme paremmin hahmottamaan abstrakteja asioita.
3.4 Atomin perusrakenne
Nykytietämyksen mukaan atomi koostuu ytimestä ja sitä ympäröivästä elektronipilvestä. Ytimessä on tiukasti pakattuna sekä positiivisesti varautuneita protoneita että varauksettomia neutroneita. Elektronipilvessä olevilla elektroneilla on negatiivinen sähkövaraus. Yhden elektronin sähkövarausta kutsutaan myös alkeisvaraukseksi ja sen suuruus on (yksikkönä coulombi). Protonin ja elektronin varaus on täsmälleen yhtä suuri, mutta erimerkkinen. Neutronien määrä atomin ytimessä on yleensä sitä suurempi mitä raskaampi alkuaine on kyseessä.
- Protonien määrä ytimessä määrittää, mikä alkuaine on kyseessä.
- Ulospäin atomi on aina sähköisesti varaukseton, joten siinä on oltava yhtä monta protonia ja elektronia.
Atomin massasta yli 99,9% on atomin ytimessä. Vaikka atomin massa on keskittynyt ytimeen, on ydin kuitenkin hyvin pieni suhteessa atomin kokoon. Jos atomi olisi jalkapallostadionin kokoinen, atomin ydin olisi vain herneen kokoinen! Ytimen ulkopuolella atomi on siis enimmäkseen tyhjää tilaa.
Vastakkaismerkkiset sähkövaraukset vetävät toisiaan puoleensa. Tästä syystä negatiiviset elektronit pysyvät positiivisen ytimen ympärillä. Samanmerkkiset varaukset hylkivät toisiaan, joten ytimessä olevat positiiviset protonit työntävät toisiaan poispäin. Miten ydin kuitenkin pysyy koossa? Hylkimisvoimaa voimakkaampi ydinvoima sitoo protonit ja neutronit ytimeen.
| Hiukkanen | Sähkövaraus (C) | Massa (u) | Massa (g) | Sijaitsee |
|---|---|---|---|---|
| Protoni | 1 | Atomin ytimessä | ||
| Neutroni | 1 | Atomin ytimessä | ||
| Elektroni | 0,0055 | Elektronipilvessä |
Taulukossa on esitetty hiukkasten sähkövaraukset (yksikkönä coulombi), massat grammoina (g) ja atomimassayksiköissä (u) sekä hiukkasten sijainti atomissa
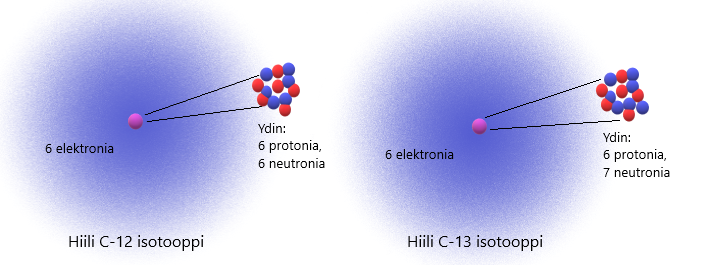
3.5 Isotoopit
Samalla alkuaineella on aina yhtä monta protonia ytimessään, mutta neutronien lukumäärä voi vaihdella. Saman alkuaineen atomeja, joilla on eri määrä neutroneja ytimessään, kutsutaan isotoopeiksi. Kaikilla alkuaineilla on olemassa isotooppeja, mutta vain osa niistä on pysyviä ja osa hajoaa itsestään. Itsestään hajoavia isotooppeja kutsutaan radioisotoopeiksi ja ne emittoivat säteilyä hajotessaan.
- Järjestysluku Z = protonien lukumäärä
- Massaluku A = järjestysluku Z + neutronien lukumäärä
Atomin ytimessä olevien protonien lukumäärä on kullekin alkuaineelle ominainen. Tätä lukua kutsutaan järjestysluvuksi Z. Massaluku A sitä vastoin kuvaa atomin ytimessä olevien protonien ja neutronien lukumäärää. Massalukuja voi saman alkuaineen atomeilla olla useita ja tällöin ne ovat isotooppeja.
Isotoopin massaluku voidaan ilmaista yläindeksinä ja järjestysluku alaindeksinä, kuten alla olevassa kuvassa on esitetty. Isotooppimerkinnän perusteella voidaan kertoa, kuinka monta protonia, neutronia ja elektronia kyseessä olevalla isotoopilla on.
Esimerkki
Kuinka monta protonia, neutronia ja elektronia on hiilen C-12 isotoopilla, jonka isotooppimerkintä on ?
Vastaus
- Z = 6 eli hiilellä on 6 protonia
- Atomilla on protoneja aina yhtä monta kuin elektroneja, joten elektroneja on myös 6
- Massaluku on protonien ja neutronien yhteismäärä, joten vähentämällä massaluvusta protonien lukumäärän, saadaan neutronien lukumäärä.
eli hiilellä on 6 neutronia
Esimerkki
Kuinka monta protonia, neutronia ja elektronia on piin isotoopilla, jonka isotooppimerkintä on
?
protonia
elektronia
neutronia
3.6 Atomimallit ja elektronirakenteen mallintaminen
Olet ehkä peruskoulussa tutustunut Bohrin atomimalliin, jossa elektronit ovat kuoriksi kutsutuilla radoilla ytimen ympärillä. Samalla kuorella olevilla elektroneilla on sama energia ja mitä kauempana kuori on atomin ytimestä, sitä korkeampi energia sillä on. Tämä malli on hyvin pelkistetty, eikä se riitä selittämään monielektronisten atomien elektronirakennetta. Malli on myös osittain virheellinen, sillä elektronit eivät kierrä atomia pysyvillä radoilla.
Bohrin atomimalli ennustaa, että elektronit sijoittuvat kuorille kaavan mukaan eli ensimmäiselle kuorelle mahtuu
elektronia, toiselle kuorelle
elektronia, kolmannelle kuorelle
elektronia ja niin edelleen. Elektronikuoret täyttyvät minimienergiaperiaatteen mukaan eli ensin täyttyy ensimmäinen kuori, jolla on matalin energia ja kun se on täynnä, alkaa toinen kuori täyttyä.
Edellä kuvatun säännön mukaan klooriatomin (Z=17) elektronirakenne voidaan kirjoittaa seuraavasti:
- kuorella 2 elektronia
- kuorella 8 elektronia
- kuorella 7 elektronia
Testaa osaamisesi!
Avaa tämä, kun olet vastannut edeltävään tehtävään
Säännön mukaisesti sijoitit todennäköisesti kalsiumin kolmannelle kuorelle yhteensä 10 elektronia, koska kolmannelle kuorelle mahtuisi 18 elektronia. Todellisuudessa kalsiumatomin elektronirakenne on kuitenkin seuraava:
- kuorella 2 elektronia
- kuorella 8 elektronia
- kuorella 8 elektronia
- kuorella 2 elektronia
Miksi elektronit asettuvat tällä tavalla? Jotta pystyisimme vastaamaan tähän kysymykseen, täytyy meidän tutustua kvanttimekaaniseen atomimalliin, joka nykytietämyksen mukaan selittää paremmin atomin elektronirakennetta.
3.7 Kvanttimekaaninen atomimalli
Bohrin atomimallin perusteella ehkä kuvittelemme, että pystymme tarkasti osoittamaan missä elektroni sijaitsee kullakin hetkellä. Voimme kyllä piirtää kuvia elektroneista kuorilla, mutta todellisuudessa emme pysty määrittämään missä elektronit ovat. Elektronit ovat äärimmäisen pieniä, nopeasti kulkevia hiukkasia, joilla on kvanttimekaniikan mukaan sekä hiukkasen että aallon ominaisuuksia. Elektronit eivät liiku mitään tiettyä rataa pitkin. Kvanttimekaanisessa atomimallissa tarkkojen ratojen sijasta ennustetaan matemaattisesti, mistä elektronipilven osasta elektroni todennäköisimmin löytyy.
Tiedämme, että elektronien energia on kvantittunut. Tämä tarkoittaa sitä, että vain tietyt energian arvot ovat mahdollisia. Minimienergiaperiaatteen mukaisesti elektronit asettuvat aina mahdollisimman alhaisille energiatasoille. Ympyrän muotoisten ratojen sijaan kvanttimekaanisessa atomimallissa elektronirakennetta kuvataan orbitaaleilla, jotka kuvaavat sitä avaruudellista aluetta, josta elektronit kaikkein todennäköisimmin voidaan löytää. Huomaa kuitenkin, että elektronit eivät välttämättä ole tällä alueella, vaan ne voivat löytyä myös muualta.
Elektronien mahdolliset energiatasot luokitellaan kvanttimekaanisessa atomimallissa seuraavasti:
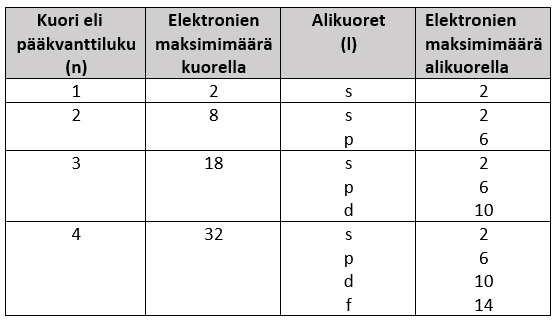
3.7.1 Alikuoret ja orbitaalit
Alikuoret s, p, d ja f määräävät orbitaalin muodon. Tämä tarkoittaa sitä, että esimerkiksi s-orbitaali on pallon mallinen. Kullekin orbitaalille mahtuu kaksi elektronia.
- Alikuori s sisältää yhden s-orbitaalin.
- Alikuori p sisältää kolme p-orbitaalia
- Alikuori d sisältää viisi d-orbitaalia
- Alikuori f sisältää seitsemän f-orbitaalia
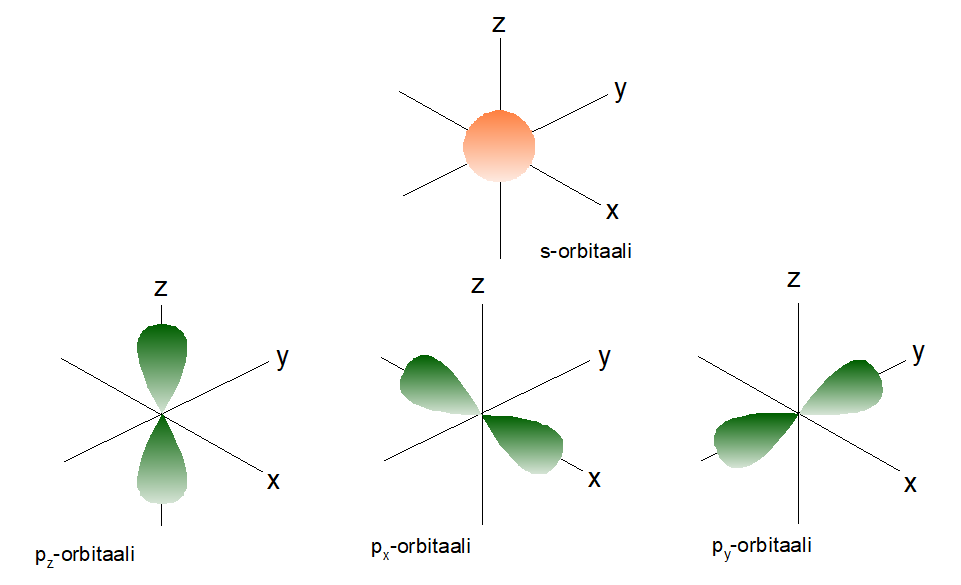
Orbitaalit perustuvat matemaattisiin laskelmiin. Schrödingerin aaltoyhtälön avulla voidaan laskea todennäköisyys sille, millä alueella elektronit todennäköisimmin sijaitsevat. Yhtälön ratkaisut edustavat siis sitä avaruuden tilaa, josta elektronit voidaan todennäköisimmin löytää.
Eri orbitaalien avaruudellista muotoa kolmiulotteisena voi tarkastella seuraavista linkeistä:
Tästä pääset myös vertailemaan 1s, 2s, 2p ja 3s orbitaalien muotoa ja suhteellista kokoa.
Kvanttimekaanisen atomimallin mukaan pääkvanttiluvun mukaisilla energiatasoilla (eli kuorilla) on alikuoria (s, p, d, f), joilla on erilaisia energioita. Aluksi energiatasot kasvavat loogisessa järjestyksessä, mutta huomaamme, että myöhemmin energiatasot menevät hieman lomittain. Esimerkiksi alikuorien 4s ja 3d energiat ovat lähellä toisiaan. Tässä tarkastelemme vain pääkvanttilukuja 1-4, mutta mikäli ottaisimme vielä viidennen pääkvanttiluvun mukaan, tulisi energiakaaviosta vielä monimutkaisempi.
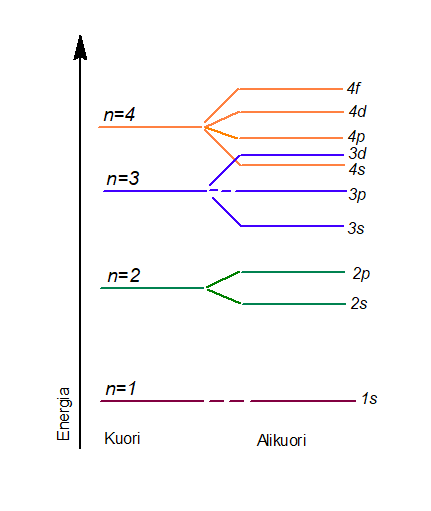
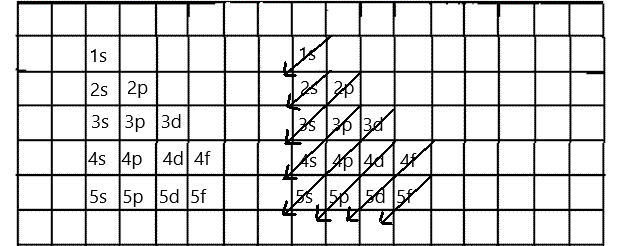
3.7.2 Elektronirakenteen kirjoittaminen kvanttimekaanisen atomimallin mukaan
Alikuorien täyttymisjärjestykselle on olemassa hyvä muistisääntö. Kirjoita alikuoret (esimerkiksi ruutupaperille) niin, että saman pääkvanttiluvun alikuoret tulevat vierekkäin ja kaikki s-alikuoret tulevat allekkain kuvan mukaisesti. Piirrä tämän jälkeen nuolet kulmasta kulmaan, aloittaen oikeasta yläkulmasta. Nyt voit lukea alikuorien täyttymisjärjestyksen: Koska alikuoret täyttyvät minimienergiaperiaatteen mukaan, tämä on samalla kuorien energiajärjestys. Matalaenergisin alikuori on 1s ja korkeaenergisin alikuori on 5f.
Kvanttimekaanisen atomimallin mukainen elektronirakenne kirjoitetaan alikuorittain. Elektronirakennetta kirjoittaessa on myös muistettava, montako elektronia kullekin alikuorelle mahtuu. Esimerkiksi klooriatomin (Z = 17) elektronirakenne on: Kullakin alikuorella olevien elektronien lukumäärä kirjoitetaan yläindeksiin. Elektronirakenteesta voimme lisäksi nähdä, että uloimmalla kuorella (3. kuorella) kloorilla on 2 + 5 = 7 elektronia.
Kemiassa olemme yleensä kiinnostuneimpia uloimman kuoren elektroneista eli valenssielektroneista, sillä ne osallistuvat kemiallisiin reaktioihin.
Esimerkki
a) Kirjoita raudan elektronirakenne kvanttimekaanisen mallin mukaisesti.
b) Kuinka monta elektronia raudalla on uloimmalla kuorella?
7
—Vastaus
a) Raudan ()
, joten raudalla on 26 elektronia. Elektronit asettuvat alikuorille minimienergiaperiaatteen mukaan seuraavasti:
- 1s: 2 elektronia
- 2s: 2 elektronia
- 2p: 6 elektronia
- 3s: 2 elektronia
- 3p: 6 elektronia
- 4s: 2 elektronia
- 3d: 6 elektronia
Nyt voidaan kirjoittaa raudan elektronirakenne: Huomaa, että 3d alikuori kirjoitetaan muiden n=3 alikuorien kanssa peräkkäin, vaikka se täyttyy vasta 4s-alikuoren jälkeen.
b) Uloimmalla kuorella eli 4. kuorella on raudalla 2 elektronia.
3.8 Tehtävät ja lisämateriaali
Muita linkkejä opiskelun tueksi:
These are the current permissions for this document; please modify if needed. You can always modify these permissions from the manage page.
