6. Ainemäärä - tehtävät
6.1 Tehtävä

6.2 Tehtävä
Millä tavalla esittäisit makroskooppisella, submikroskooppisella ja symbolisella tasolla yhtä moolia vettä? (Pohdi, kuinka pystyisit kuvaamaan moolin vettä makroskooppisella tasolla niin, että heti kuvaa katsottaessa selviää, että siinä on mooli vettä.)
Tee kuva haluamallasi ohjelmalla, jossa yksi mooli vettä on esitetty kaikilla kolmella tasolla ja lataa kuva tiedostona alla olevaan palautuskenttään. Voit halutessasi myös piirtää paperille, ottaa piirroksesta kuvan ja palauttaa sen kuvana alla olevaan palautuskenttään. Selitä myös sanallisesti, millä perustein kuvasit makroskooppista, submikroskooppista ja symbolista tasoa valitsemallasi tavalla.
6.3 Tehtävä
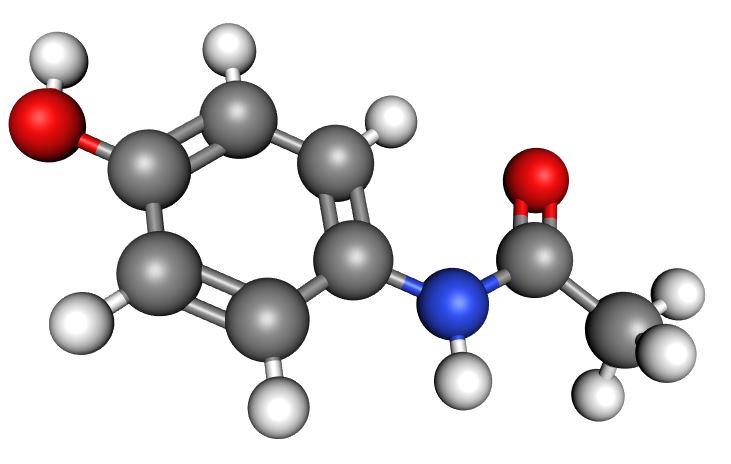
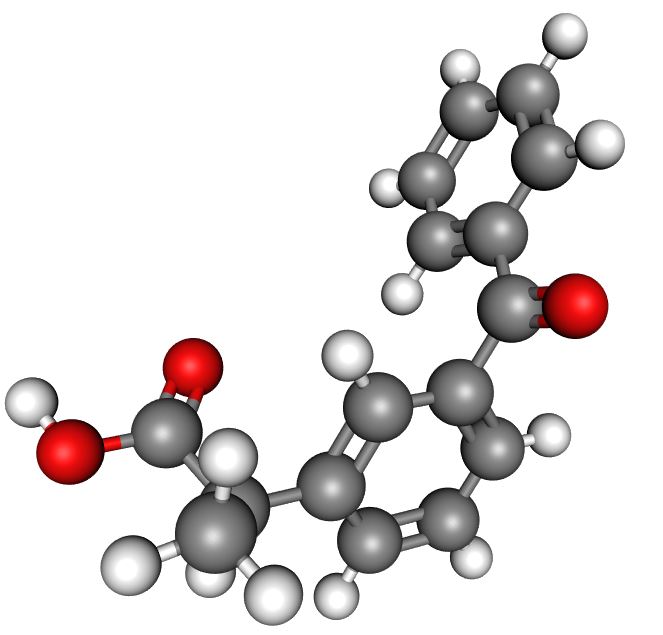
Mikä on seuraavien aineiden perusosanen? Kirjoita aineen kemiallinen kaava ja valitse kuvista, mikä niistä kuvaa kunkin aineen perusosasta.
Alaindeksit saat kirjoittamalla _ -merkin (alaviiva) ja tämän jälkeen alaindeksin numeron. Mikäli alaindeksissä on useampi merkki, kirjoita numero hakasulkujen sisään { }. Esimerkiksi kemiallisen kaavan saat kirjoittamalla C_7H_{16}O
6.4 Tehtävä
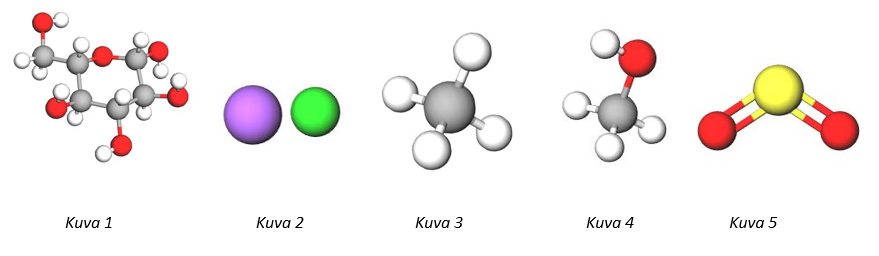
a) Vesimolekyylin rakennetta voidaan esittää submikroskooppisella tasolla seuraavan mallin avulla:
Mikäli vesimolekyylejä on 1 mooli, niin kuinka monta moolia on vetyatomeja ja kuinka monta moolia happiatomeja?
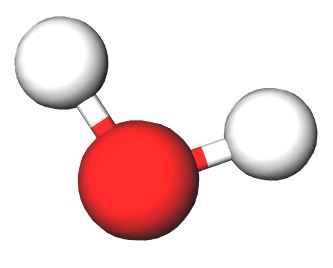
b) Typpitrifluoridin () rakennetta voidaan esittää seuraavan mallin avulla:
Kuinka monta moolia fluoriatomeja on kahdessa moolissa typpitrifluoridia?
6.5 Tehtävä
Sakkaroosi eli tavallinen sokeri on disakkaridi. Se koostuu kahdesta monosakkaridista: glukoosista ja fruktoosista. Sakkaroosin kemiallinen kaava on .

6.6 Tehtävä
Laske moolimassa seuraaville molekyyleille
a) Asetyylisalisyylihappo ()
b) Parasetamoli ()
c) Ketoprofeeni ()
6.7 Tehtävä
Laske moolimassa seuraaville molekyyleille
a) Etyleeniglykoli ()
b) Propyleeniglykoli ()

6.8 Tehtävä
Järjestä seuraavat näytteet perusosasten lukumäärän mukaiseen järjestykseen pienimmästä hiukkasmäärästä suurimpaan
A. 0,15 mol sinkkiä ()
B. 1 mol ammoniumkloridi ()
C. 0,2 mol etanoli ()
D. 1,3 mol vesi
6.9 Tehtävä
Laske ainemäärä seuraaville:
a) 35,5 g Zn
b) 21,1 g Li
c) 50 g MgO
6.10 Tehtävä
Laske ainemäärä seuraaville:
6.11 Tehtävä
Järjestä seuraavat näytteet järjestykseen ainemäärältään pienimmästä suurimpaan
A. 1,3 mol bentsoehappo ()
B. 100 g natriumdisulfiitti ()
C. 0,4 mol ksylitoli ()
D. 10 g asesulfaami K ()
6.12 Tehtävä
Valitse kummassa on enemmän molekyylejä
md:a\)Yhdessä grammassa vettä vai yhdessä grammassa metaania ($CH_4$)?
md: b\)Yhdessä kilogrammassa lunta vai yhdessä kilogrammassa vettä?
md: c\)Yhdessä kilogrammassa etikkahappoa ($CH_3COOH$) vai yhdessä grammassa etikkahappoa?
md: d\)Kahdessa moolissa natriumglutamaattia ($C_5H_8NNaO_4$) vai kahdessa moolissa dietyylieetteriä ($C_4H_{10}O$)?
6.13 Tehtävä
Aspartaamia () käytetään makeutusaineena esimerkiksi monissa sokerittomissa virvoitusjuomissa. Aspartaami muistuttaa maultaan tavallista sokeria (eli sakkaroosia), mutta on sitä jopa 200 kertaa makeampaa. Elintarvikepakkauksissa aspartaami on koodilla E951.

a) Laske aspartaamin moolimassa
b) Mikä on aspartaamin ainemäärä, jos massa on 294,3 g?
c) Kuinka monta molekyyliä on yhdessä moolissa aspartaamia?
6.14 Tehtävä
Sinkkiasetaatin syöminen voi tutkimusten mukaan lyhentää flunssan kestoa. Sinkkiasetaatin kemiallinen kaava on .
Open plugin
b) Laske sinkkiasetaatin moolimassa
c) Eräs sinkkiasetaattitabletti sisältää sinkkiä 15 mg. Kuinka monta milligrammaa sinkkiasetaattia tabletti sisältää?
6.15 Tehtävä
Maanviljelijä haluaa lannoittaa peltonsa ja ostaa kolme 400 kg:n säkkiä salpietaria. Salpietari on järjestelmälliseltä nimeltään kaliumnitraatti ().
a) Laske kaliumnitraatin moolimassa
b) Laske maanviljelijän ostaman salpietarin ainemäärä
6.16 Tehtävä
Propaania () sisältävä kaasupullo punnittiin ennen käyttöä ja sen massaksi saatiin 667 g. Kaasupullon kyljessä lukee, että pullossa on 450 g propaania. Kaasua käytetään viikonlopun retkellä kahvin keittoon ja ruoan valmistukseen. Retken jälkeen kaasupullo punnitaan uudelleen ja massaksi saadaan 295 g. Mikä ainemäärä propaania pullossa on jäljellä retken jälkeen?

6.17 Tehtävä
Taululiitu koostuu pääasiassa kalsiumkarbonaatista (). Liitu punnitaan ennen oppitunnin alkua ja sen massaksi saadaan 9,81 g. Oppitunnin aikana liitutaululle kirjoitetaan muistiinpanoja ja opettaja käy läpi 2 laskuesimerkkiä. Tunnin päätteeksi liitu punnitaan uudelleen ja massaksi saadaan 9,28 g.
a) Laske kalsiumkarbonaatin ainemäärä liidussa ennen oppituntia. Voit olettaa, että liitu on puhdasta kalsiumkarbonaattia.
b) Kuinka monta kalsiumkarbonaattimolekyyliä liitutaululla on oppitunnin päätteeksi, kun oletetaan, että kaikki muistiinpanot ja esimerkit mahtuvat samaan aikaan taululle?
6.18 Tehtävä
Yhteen piimäkakkuun tulee ruokasoodaa () teelusikallinen. Sinun pitäisi tehdä tupla-annos piimäkakkua, mutta mittavälineenä on vain vaaka. Onneksi muistat kuulleesi kemian tunnilla, että ainemäärä yhdessä teelusikallisessa ruokasoodaa on noin 0,13 mol. Laske, kuinka monta grammaa ruokasoodaa tarvitset tupla-annokseen piimäkakkua.
6.19 Tehtävä
Silikageeliä () käytetään paljon kuivausaineena, sillä se sitoo vettä erittäin tehokkaasti. Oletetaan, että yhtä
-molekyyliä kohden sitoutuu keskimäärin kaksi vesimolekyyliä. Kuinka monta grammaa vettä 450 g silikageeliä pystyy sitomaan?
6.20 Tehtävä
6.21 Tehtävä
Tarkastele seuraavaa reaktioyhtälöä ja vastaa alla oleviin kysymyksiin.
a) Jos 1,2 mol fosforitrikloridia () reagoi, niin kuinka monta moolia fosforihapoketta (
) muodostuu?
b) Jos reaktiossa muodostuu 1,2 mol suolahappoa (), niin kuinka monta moolia fosforitrikloridia (
) reagoi?
c) Laske a-kohdassa muodostuneen fosforihapokkeen massa.
6.22 Tehtävä
Kaasuautossa käytetään polttoaineena metaania. Metaanin palamista voidaan kuvata tasapainotetulla reaktioyhtälöllä:
a) Eräs kaasuauto kuluttaa metaania 4 kg sadalla kilometrillä. Kuinka paljon (grammoina) syntyy vettä sadalla kilometrillä?
b) Liikennekäytössä olevien henkilöautojen keskimääräinen -päästö oli vuonna 2018 157,6 g/km [1]. Tuottaako a-kohdan kaasuauto enemmän vai vähemmän hiilidioksidia kuin henkilöautot keskimäärin?
Open plugin
6.23 Tehtävä
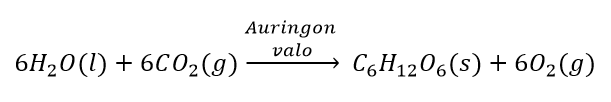
Fotosynteesillä eli yhteyttämällä kasvit tuottavat hiilidioksidin, veden ja auringon valon avulla glukoosia ja happea. Fotosynteesiä voidaan kuvata seuraavalla tasapainotetulla reaktioyhtälöllä:
Kuinka monta grammaa vettä ja hiilidioksidia tarvitaan, jotta kasvi pystyy tuottamaan 100 g glukoosia?
6.24 Tehtävä
Seuraava lasku on valmiiksi laskettuna, mutta siinä on virhe. Etsi virhe ja selitä omin sanoin, kuinka tehtävä olisi pitänyt laskea.
Tehtävä:
Etanolin palamisreaktio voidaan kuvata seuraavalla reaktioyhtälöllä: Jos 10 mol etanolia palaa, kuinka paljon hiilidioksidia muodostuu grammoissa?
Ratkaisu:
Etanolia palaa 460,68 g, joten hiilidioksidia muodostuu kaksinkertainen määrä eli
Apukappale
These are the current permissions for this document; please modify if needed. You can always modify these permissions from the manage page.