Kemian perusteet 2 (KEMP112)
Kemian perusteet 2 -kurssi käsittelee seuraavia aiheita:
- Molekyylien väliset vuorovaikutukset
- Aineen olomuodot ja faasimuutokset
- Liuoskemiaa; liukoisuus, kolligatiiviset ominaisuudet
- Reaktiokinetiikka, kemiallinen tasapaino
- Hapot ja emäkset, pH, puskuriliuokset
- Termodynamiikka, entropian ja Gibbsin energian muutokset
- Sähkökemia; sähkökemialliset kennot, normaalipotentiaali ja kennopotentiaali, elektrolyysi
Aineen olomuoto ja molekyylien väliset vuorovaikutukset, osa 1
Tässä kappaleessa tutustutaan molekyylien välisiin vuorovaikutuksiin ja siihen, kuinka vuorovaikutukset vaikuttavat aineen ominaisuuksiin ja olomuodon muutoksiin.
1. Kondensoitunut olomuoto: neste ja kiinteä
1.1 Olomuoto
Aineen tila, joka määrittää sen fysikaalista käyttäytymisen.
Esimerkiksi veden olomuodot: kiinteä (jää), neste (vesi) ja kaasu (vesihöyry). Plasma luetaan myös aineen yhdeksi olomuodoksi.

1.2 Faasi
Systeemi, jonka kemiallinen koostumus ja fysikaalinen tila ovat yhtenäiset (tasakoosteinen, homogeeninen) koko tarkasteltavassa systeemissä. Faasi on siten homogeeninen olomuotoalue, jonka erottaa toisesta faasista rajapinta.
Esimerkiksi pentaani ja vesi muodostavat sekoittumattoman liuoksen, jossa on kaksi nestefaasia.
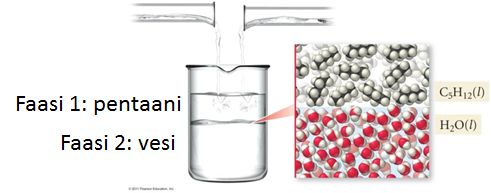
Puhekielessä faasia käytetään usein puhuttaessa myös aineen olomuodosta. Esimerkiksi aikaisemmassa kuvassa esiintyy veden olomuodot. Järven pinnalla on kontaktissa jää ja vesi sekä ilmassa oleva vesihöyry (kaasu). Yhdessä ne muodostavat järjestelmän tai systeemin, jossa esiintyy kolme faasia, eli olomuotoaluetta. Voidaan myös sanoa, että tässä systeemissä on kolme faasia, jotka koostuvat veden eri olomuodoista.
1.3 Nesteen ja kiinteä olomuodon ominaisuuksia
Neste ja kiinteä olomuoto poikkeavat kaasusta. Seuraavassa taulukossa on esitetty keskeisiä ominaisuuksia eri olomuodoille.
| Kiinteä, kiteinen aine Solid (s) |
Neste Liquid (l) |
Kaasu Gas (g) |
|---|---|---|
| Järjestynyt rakenne |
Epäjärjestys | Epäjärjestys |
| Rakenneosasilla tietyt paikat |
Rakenneosaset voivat liikkua vapaasti toistensa ohi |
Rakenneosaset voivat liikkua täysin vapaasti toistensa ohi |
| Aineella muoto ja tilavuus |
Ottaa astian muodon. Pisaralla tietty muoto. |
Ottaa astian muodon ja täyttää koko tilavuuden |
| Kiinteällä aineella on rajapinta |
Nesteellä on rajapinta |
Ei rajapintaa |
| Kokoonpuristumaton | Lähes kokoonpuristumaton |
Kokoonpuristuva |
Taulukon perusteella voidaan huomata nesteellä ja kiinteällä olevan yhtäläisyyksiä, jotka erottavat ne kaasusta.
- Nesteellä ja kiinteällä on pinta (esim. jääkuutiolla on pinta ja nesteellä astiassa on pinta).
- Kaasu on kokoonpuristuvaa, kun taas nesteen tai kiinteän kokoonpuristaminen vaatisi erittäin suuria voimia.
- Kaasussa rakenneosaset liikkuvat täysin vapaasti, nesteessä niitä pitää koossa vuorovaikutukset ja ne liikkuvat toistensa lomitse. Kiinteässä aineessa vuorovaikutukset "lukitsevat" rakenneosaset paikoilleen (värähtelemään).
Aineen tiheys on kaasussa huomattavasti pienempi kuin nesteessä tai kiinteässä.
| Olomuoto | Lämpötila (\(^\circ \text{C}\)) | Tiheys (kg/l) | Moolitilavuus (l/mol) |
|---|---|---|---|
| Kaasu | 100 | \(5,90\times10^{-4}\) | 30 |
| Neste | 20 | 0,998 | 0,018 |
| Kiinteä | 0 | 0,917 | 0,0196 |
Huomattavaa on aineen tilavuuden muutos muutoksessa nesteestä (kiinteästä) kaasuksi. Veden höyrystyessä 1 atm:n paineessa 1 mol vettä (nesteenä 18 ml) ottaa kaasuna 30 litran tilavuuden. Tilavuuden muutos nesteen höyrystyessä on n. 1700 kertainen!
Vedellä kiinteän olomuodon tiheys on poikkeuksellisesti pienempi kuin nesteessä, ts. sama tilavuus jäätä painaa vähemmän kuin nestemäinen vesi. Tästä syystä jää kelluu ja mahdollistaa monimuotoisen elämän maapallolla.
1.4 Olomuodon muutokset
Muutoksiin olomuotojen välillä vaaditaan energiaa. Kiinteässä aineessa rakenneosaset ovat järjestäytyneet paikoilleen ja eivät liiku toisiinsa nähden. Aineen sulaessa sen rakenneosaset alkavat liikkua. Jotta liike on mahdollista, on systeemiin tuotava energiaa.
Olomuodon muutoksia voidaan tarkastella esimerkiksi veden lämpökäyrän avulla. Tuomalla energiaa lämpönä systeemiin aine sulaa. Tuomalla lisää energiaa saadaan aine kiehumaan. Käyrästä voidaan huomata, että olomuodon muutoksessa lämpötila pysyy vakiona, koska kaikki systeemiin tuotu energia menee olomuodon muutokseen.
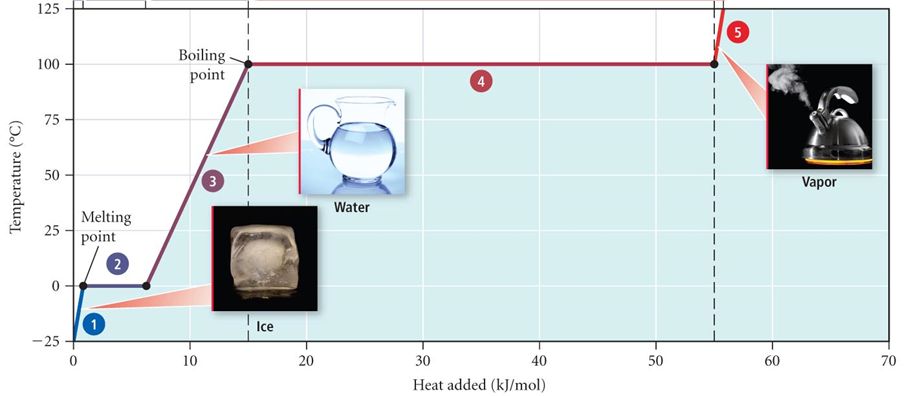
Edellä on esitetty aineen eri olomuotojen ominaisuuksia ja olomuodon muutoksiin liittyviä seikkoja. Aineen eri olomuotojen fysikaaliset ominaisuudet määräytyvät sen rakenneosasten välisten vuorovaikutusten kautta.
- Aineen sulaessa sen rakenneosaset alkava liikua toistensa ohitse. Tällöin aineeseen on tuotu energiaa sellainen määrä, joka riittää voittamaan rakenneosasia paikoillaan pitävän energia.
- Aineen kiehuessa sen rakenneosaset voivat liikkua täysin vapaasti. Tällöin aineeseen on tuotu energiaa määrä, joka ylittää rakenneosasia yhdessä pitävän energian.
Seuraavaksi tutustutaan tarkemmin aineen rakenneosasten, atomien ja molekyylien välillä oleviin vuorovaikutuksiin. Yleisesti puhutaan molekyylien välisistä vuorovaikutuksista. Niiden voimakkuus riippuu molekyylien (atomien) rakenteesta. Ne vaikuttavat aineen sulamis- ja kiehumispisteisiin, aineiden sekoittumiseen, viskositeettiin sekä muihin ominaisuuksiin. Seuraavassa kappaleessa tutustumme lähemmin millaisia molekyylien välisiä vuorovaikutuksia esiintyy ja miten ne vaikuttavat eri aineiden ominaisuuksiin.
2. Molekyylien väliset vuorovaikutukset
- Määrittelevät aineen fysikaaliset ominaisuudet ja olomuodon.
- Vuorovaikutukset molekyylien välillä pitävät aineen koossa (neste ja kiinteä).
- Molekyylien väliset vuorovaikutukset ovat sähköisiä vuorovaikutuksia varausten, osittaisvarausten sekä hetkellisten varausten välillä.
- Eivät ole kemiallista sitoutumista!
- Ovat huomattavasti heikompia kuin kemialliset sidokset.
Vesikirppu pysyy veden pinnalla veden pintajännityksen vuoksi, vesipisaran muodon määrä pintajännitys, nesteen virratessa putkissa viskositeetti vastustaa virtausta, verinäyte nousee kapillaariseen putkeen kapillaari-ilmiön ansioista... Siinä muutama esimerkki arkipäivän ilmiöistä, joiden takana ovat molekyylien väliset vuorovaikutukset.
Molekyylien väliset vuorovaikutukset vaikuttavat myös aineiden sulamis- ja kiehumispisteisiin.
2.1 Keskeiset käsitteet
2.1.1 Poolinen ja pooliton molekyyli
Poolisessa molekyylissä on pysyviä sähköisiä osittaisvarauksia. Poolisuus on seurausta molekyylin atomien elektronegatiivisuuseroista. Seuraavassa taulukossa on esitetty elektronegatiivisuuseron vaikutus kemiallisen sidoksen tyyppiin.
| Elektronegatiivisuusero | Sidoksen luonne | Esimerkki |
|---|---|---|
| 0-0,4 | Pooliton kovalenttinen | N2, Cl2 |
| 0,5-1,7 (2,0) | Poolinen kovalenttinen | HCl, HF |
| > 1,5 (2,0) | Ioninen | NaCl |
Tarkkojen rajojen asettaminen on vaikeaa ja siten yllä olevan taulukon arvot ovat suuntaa antavia.
Seuraavassa taulukossa on esitetty alkuaineiden elektronegatiivisuuksia.

Esimerkki poolisesta molekyylistä on vetykloridi. Siinä vety ja kloori (elektronegatiivisuusero 3 - 2,1 = 0,9) ovat kovalenttisesti sitoutuneet toisiinsa. Kloori elektronegatiivisena halogeenina vetää elektroneja voimakkaasti puoleensa. Vety luovuttaa osan elektronitiheydestään kloorillle. Näin vedyllä on vähemmän elektronitiheyttä kuin vapaalla vetyatomilla ja näin vety tulee positiivisesti osittaisvaratuksi ja vastaavasti kloori ottaa vastaa elektronitiheyttä vedylta ja tulee vastaavalla määrällä negatiivisesti osittaisvaratuksi. Osittaisvarauksia merkitään usein deltalla ja varauksen merkillä: \(\delta{+}\) ja \(\delta{-}\).
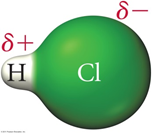
Poolittomalla molekyylillä ei ole pysyviä osittaisvarauksia. Esimerkiksi samanytimiset kaksiatomiset, kuten typpi (N2) ja vety (H2), ovat poolittomia. Myös molekyylien rakenne vaikuttaa poolisuuteen (lisätietoa: kurssikirja, kappale 10.)
2.1.2 Pysyvä dipoli
HCl-molekyylin päät ovat erimerkkisesti varatut, joten se muodostaa pysyvän dipolin. Dipoli on kahden toisistaan etäisyydellä \(r\) olevan varauksen, esim. \(\delta{+}\) ja \(\delta{-}\), muodostama systeemi.
Poolisilla molekyyleillä on pysyvä dipolimomentti, jota voidaan pitää molekyylin "poolisuuden mittarina". Dipolimomentti määritellään kahden, etäisyydellä \(r\) toisistaan olevan varauksen (\(\delta{+}\) ja \(\delta{-}\)) avulla: \[\mu=\delta{r},\] missä \(\delta=|\delta{+}|=|\delta{-}|\).
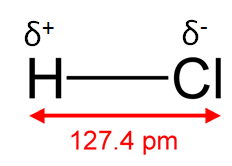
Esimerkiksi HCl:n dipolimomentti on \(\mu=1,05\,\text{D}\) (yksikkö 1 D = 1 Debye = 3,33564 \(\times\) 10−30 Cm (Coulombimetri)).
2.1.3 Hetkellinen dipoli
Hetkellinen dipoli muodostuu atomiin tai poolittomaan molekyyliin, koska elektroniverho ei ole staattinen. Yhdellä ajanhetkellä atomin tai molekyylin elektronitiheys voi olla suurempi toisella puolella ydintä/molekyyliä, jolloin sinne muodostuu pieni hetkellinen negatiivinen osittaisvaraus. Vastaavasti alemman elektronitiheyden alueelle muodostuu vastaava hetkellinen positiivinen osittaisvaraus. Näin molekyylille tai atomille muodostuu hetkellinen dipolimomentti.
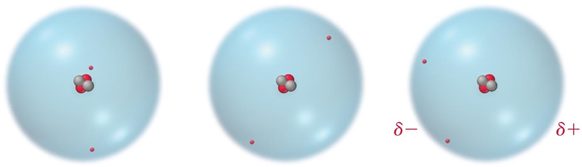
Samalla tavalla hetkellinen dipolimomentti syntyy myös mm. typpimolekyylille. Myös poolisilla molekyyleillä on hetkellinen dipolimomentti (pysyvä dipoli momentti muuttuu), mutta hetkellinen dipolimomentti on niin pieni verrattuna pysyvän dipolimomentin suuruuteen, että se voidaan jättää huomiotta.
2.1.4 Sidosdipoli
Moniatomisessa molekyylissä eri sidokset voivat olla poolisia tai poolittomia. Esimerkiksi lineaarisessa hiilidioksidimolekyylissä, CO2, elektronegatiivisempi happi vetää hiilen elektroneja puoleensa. Happi tulee negatiivisesti osittaisvaratuksi ja vastaavasti hiiliatomi positiivisesti osittaisvaratuiksi. Näin molempiin CO-sidoksiin muodostuu sidosdipolit, jotka ovat vastakkaissuuntaiset ja näin kumoavat toisensa. CO2 molekyyli itsessään on pooliton.
Vesimolekyylin rakenne on taipunut ja siten sen sidosdipolit eivät kumoa toisiaan ja siksi se on poolinen.
Kertaa tarvittaessa asiat kurssikirjan kappaleesta 10.
2.1.5 Sähköinen vuorovaikutus (Coulombin laki)
Molekyylien välinen vuorovaikutus on sähköistä vuorovaikutusta ja sen suuruus voidaan määrittää Coulombin lain avulla.
Coulombin laki kuvaa kahden pistevarauksen (\(q_1\) ja \(q_2\)), esimerkiksi molekyylin osittaisvarausten (\(\delta{+}\) ja \(\delta{-}\)), välisen sähköisen vuorovaikutuksen (vuorovaikutusenergian \(E\)) suuruutta varausten suuruuden ja niiden välisen etäisyyden (\(r\)) suhteen:
\[E = \frac{1}{4\pi\epsilon_0}\frac{q_1q_2}{r},\]
missä \(\epsilon_0 = 8,854\times10^{-12}\) F/m.
| \(q_1\) | \(q_2\) | \(E\) | Vuorovaikutuksen luonne |
|---|---|---|---|
| \(-\) | \(+\) | \(-\) | Attraktiivinen |
| \(+\) | \(-\) | \(-\) | Attraktiivinen |
| \(+\) | \(+\) | \(+\) | Repulsiivinen |
| \(-\) | \(-\) | \(+\) | Repulsiivinen |
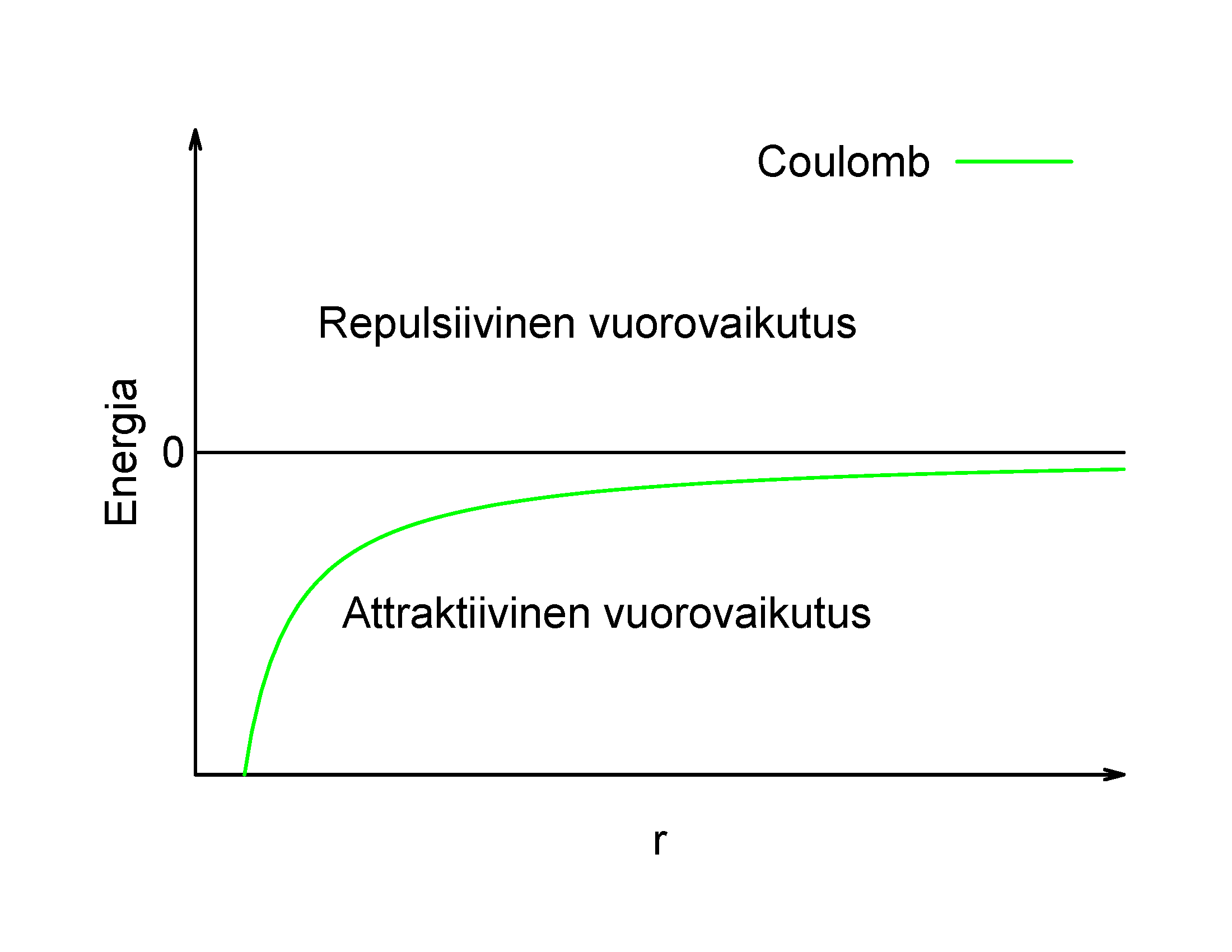
Coulombin lain mukaan erimerkkisten varausten välillä on attraktiivinen, puoleensavetävä, vuorovaikutus ja samanmerkkisten varausten välillä on repulsiivinen, hylkivä vuorovaikutus.
Coulombin lain vuorovaikutus on muotoa \(1/r\), eli mitä pienempi etäisyys, sitä suurempi attraktiivinen tai repulsiivinen vuorovaikutus on. \(r \ge 0\).
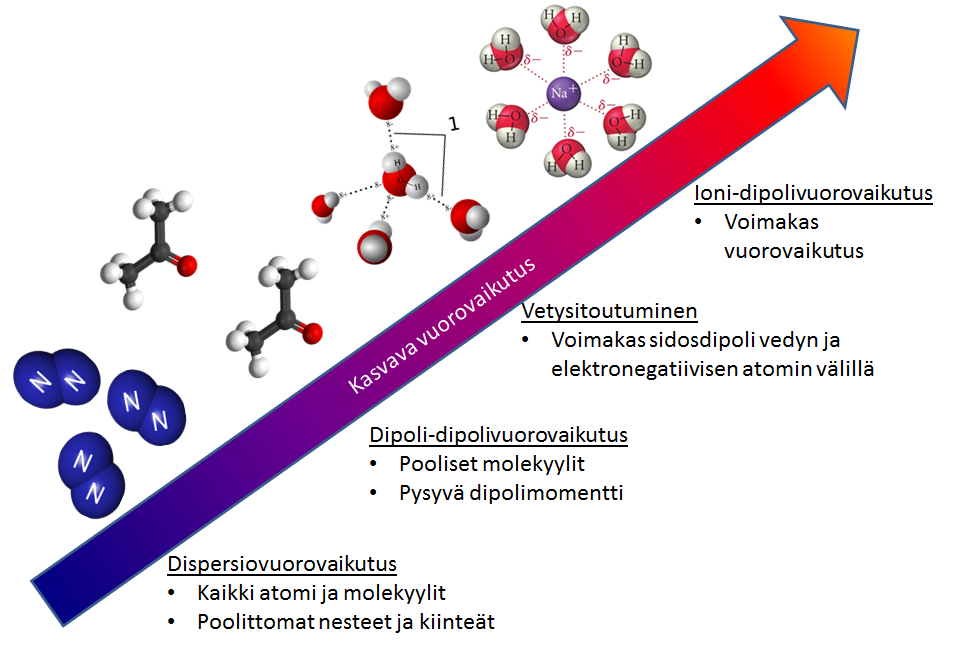
2.2 Molekyylien välisten vuorovaikutusten luokittelu
- Dipoli-dipolivuorovaikutus
- Vetysitoutuminen
- Dispersiovuorovaikutus
- Ioni-dipolivuorovaikutus
Muista: molekyylien väliset vuorovaikutukset ovat huomattavasti heikompia kuin kemialliset sidokset.
2.2.1 Dipoli-dipolivuorovaikutus
Molekyylien, joilla on pysyvä dipolimomentti, välillä vaikuttava vuorovaikutus. Esimerkkejä tällaisista molekyyleistä ovat mm. HCl, CH3Cl ja H2S. Huomautuksena on mainittava, että usein O-H- ja N-H-sidoksia sisältävät pooliset molekyylit muodostavat voimakkaita vetysidoksia, joten ne luetaan vetysitoutuneiksi yhdisteiksi, vaikka niissäkin vuorovaikutus on dipoli-dipoli tyyppistä.
Dipoli-dipolivuorovaikutusta voi havainnollistaa kahden poolisen molekyylin avulla. Kuten edellä esitettiin, on erimerkkisten varausten välillä attraktiivinen vuorovaikutus ja vastaavasti samanmerkkisten välillä repulsiivinen. Näin erimerkkiset varaukset pyrkivät lähemmäs toisiaan ja samanmerkkiset kauemmas toisistaan. Näin vuorovaikutukset vaikuttavat siihen, miten molekyylit asettuvat aineessa. Yksinkertaisimmillaan tätä voi havainnollistaa esimerkiksi kahden asetonimolekyylin avulla. 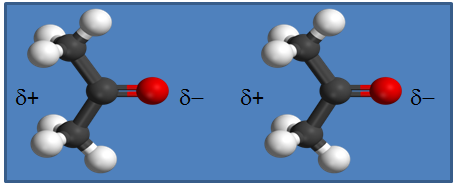
Dipolimomentin kasvaessa molekyylien välinen vuorovaikutus voimistuu. Tätä voidaan tarkastella vertaamalla eri aineiden kiehumispisteitä ja dipolimomentteja keskenään. Mitä korkeampi aineen kiehumispiste on, sitä voimakkaammat ovat molekyylien väliset vuorovaikutukset. Muistetaan, että aineen kiehuessa molekyylien liike-energia voittaa koossa pitävät vuorovaikutukset ja molekyylit liikkuvat vapaasti. 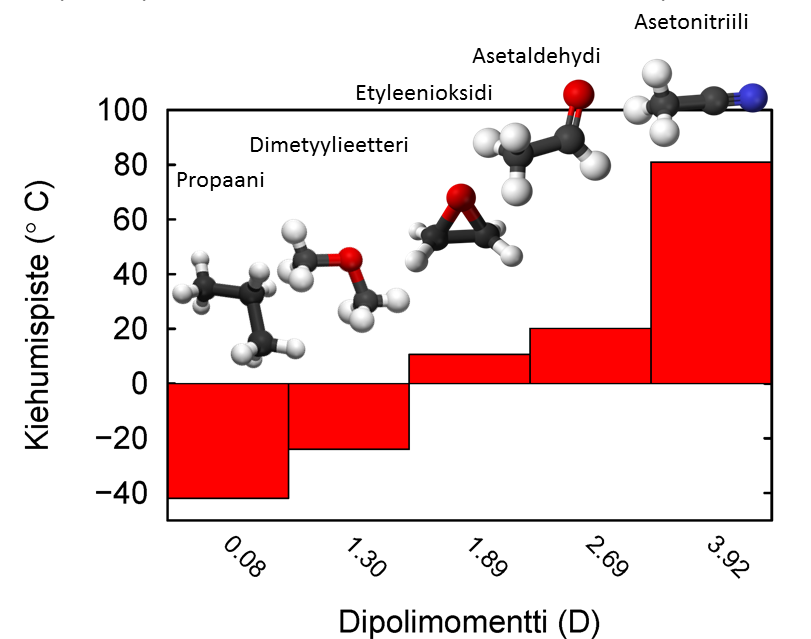
2.2.2 Vetysitoutuminen
Vetysitoumista esiintyy poolisten molekyylien, joissa esiintyy O-H- tai N-H-sidoksia, välillä sekä HF-molekyylien välillä. Esimerkkejä vetysitoutuneista yhdisteistä ovat mm. H2O, CH3OH, CH3CH2COOH, CH3CH2NH2, HF.
Vetysitoutumisessa molekyylin sidoksen päässä oleva positiivisesti osittaisvarautunut vety vuorovaikuttaa naapurimolekyylin elektronegatiivisen ja siten negatiivisesti osittaisvaratun O-, N-, tai F-atomin kanssa. Kyseessä on eräänlainen dipoli-dipolivuorovaikutus, jossa suuret elektronegatiivisuuserot vedyn ja hapen, typen tai fluorin välillä aiheuttavat voimakkaan vuorovaikutuksen näiden atomien välillä ja siten vaikuttavat siihen, miten molekyylit asemoituvat toisiinsa nähden.
Vetysitoutumiseen olennaisena kuuluu tyypillinen rakenne, jossa esimerkiksi veden tapauksessa vesimolekyylin vetyatomi vetysitoutuu toisen vesimolekyylin happeen. Tätä merkitään usein merkinnällä -O---H-O-, jossa lyhyt viiva (-) esittää molekyylin sidosta ja katkoviiva (---) molekyylien välistä vetysitoutumista.
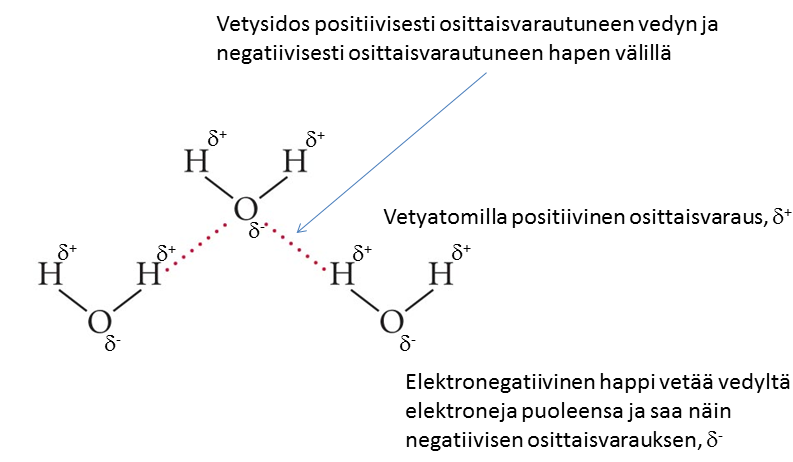
Vetysitoutumisesta johtuen veden ominaisuudet ovat uniikit poiketen samankaltaisten molekyylien ominaisuuksista. Esimerkiksi vesimolekyylin kiehumispiste on huomattavasti korkeampi kuin rakenteellisesti samankaltaisella rikkivedyllä H2S. Korkean kiehumispisteen ansioista vesi pysyy nesteenä maapallolla. Toinen vetysitoutumisesta seuraava ominaisuus on veden kiinteän olomuodon eli jään pienempi tiheys verrattuna nesteeseen. Näin jää kelluu veden pinnalla. Tämä on seurausta siitä, että vetysidosten vaikutuksesta molekyylit asettuvat kiinteässä olomuodossa siten, että niiden väliin jää keskimääräisesti enemmän tilaa verrattuna nesteeseen. Voidaan sanoa, että vetysidos lukitsee molekyylit kiinteässä olomuodossa tiettyy rakenteeseen.
2.2.3 Dispersiovuorovaikutus
Dispersiovuorovaikutus on keskeinen vuorovaikutus poolittomien molekyylien ja esimerkiksi jalokaasuatomien välillä. Dispersiovuorovaikutus perustuu vuorovaikutukseen hetkellisten dipolimomenttien välillä ja on heikoin molekyylien välinen vuorovaikutus. Sen avulla voidaan selittää, miksi esimerkiksi poolittomat happi, typpi ja jalokaasut nesteytyvät ja kiinteytyvät.
Tarkastelemalla jalokaasujen kiehumispisteitä voidaan tehdä johtopäätöksiä, kuinka kasvava atomimassa vaikuttaa dispersiovuorovaikutuksen voimakkuuteen.
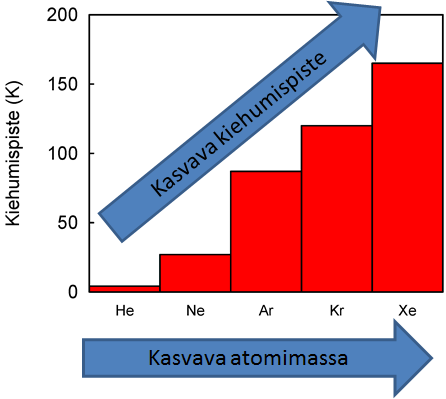
- Mitä suurempi atomimassa, sitä suurempi dispersiovuorovaikutus ja siten myös kiehumispiste.
- Suurempi atomimassa tarkoittaa myös suurempaa määrää elektroneja, jolloin valenssielektronit ovat kauempana ytimestä ja siten helpommin polaroitavissa.
Dispersiovuorovaikutuksen voimakkuuteen vaikuttaa myös molekyylirakenne. Molekyylimassaltaan ja koostumukseltaan samankaltaisilla poolittomilla molekyyleillä voi olla hyvin erilaiset ominaisuudet.
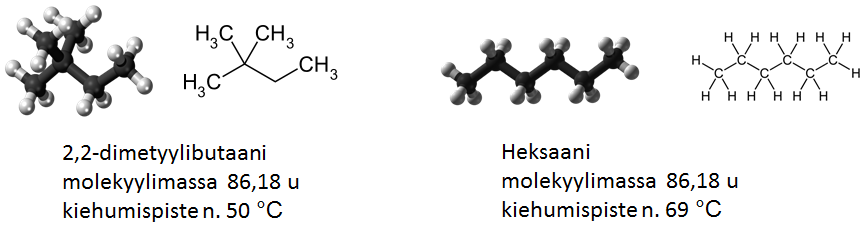
Heksaanin kiehumispiste on korkeampi kuin 2,2-dimetyylibutaanilla, joten heksaanimolekyylien välillä on suurempi dispersiovuorovaikutus.
Suoraketjuisten molekyylien vuorovaikutukset ovat voimakkaammat kuin vastaavan molekyylimassan omaavilla ei-suoraketjuisilla molekyyleillä.
Suoraketjuisilla molekyyleillä on suurempi vuorovaikutusala ja siten vuorovaikutus on suurempi.
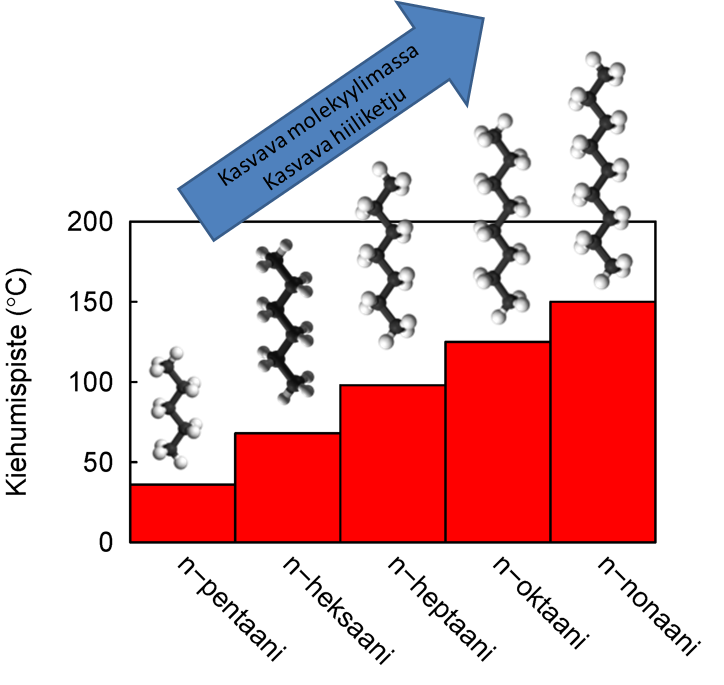
Hiilivetyketjujen pidentyessä vuorovaikutus kasvaa kasvavan molekyylimassan ja vuorovaikutusalan mukana.
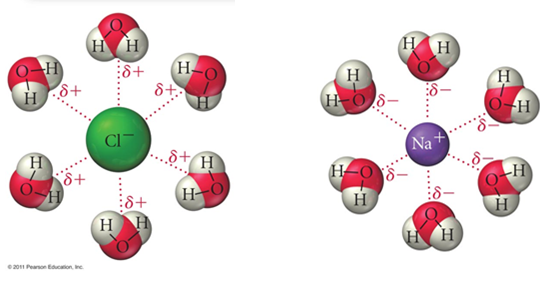
2.2.4 Ioni-dipolivuorovaikutus
Ioni-dipolivuorovaikutus on voimakkain molekyylien välisistä vuorovaikutuksista. Kuten nimestäkin voi päätellä, kyseessä on ionin ja poolisen molekyylin välinen vuorovaikutus. Tyypillisesti ioni-dipolivuorovaikutuksia esiintyy suolojen vesiliuoksissa, kuten natriumkloridin vesiliuoksessa, jossa Na+- ja Cl--ionit vuorovaikuttavat vesimolekyylien kanssa.
2.2.5 Molekyylien välisten vuorovaikutusten voimakkuus
| Vuorovaikutus | Esiintyminen | Voimakkuus |
|---|---|---|
| Dispersio | Kaikki molekyylit\ | 0,05 - 20 kJ/mol |
| ja atomit | ||
| Dipoli-dipoli | Pooliset molekyylit\ | 3-20 kJ/mol |
| Vetysitoutuminen | Molekyylit, joissa H on\ | 10-40 kJ/mol |
| sitoutunut F-, O- tai N-\ | ||
| atomiin | ||
| Ioni-dipoli | Ionien ja poolisten\ | 30-100 kJ/mol |
| molekyylien seokset |
2.3 Tehtäviä
2.4 Molekyylien välisten vuorovaikutusten aiheuttamia ilmiöitä
2.4.1 Nesteiden sekoittuminen
Vanha viisaus poolinen liukenee pooliseen ja pooliton poolittomaan on seurausta molekyylien välisten vuorovaikutusten voimakkuuksista. Vesi ja pentaani eivät sekoitu keskenään vaan ne muodostavat kaksi toisiinsa sekoittumatonta nestefaasia.
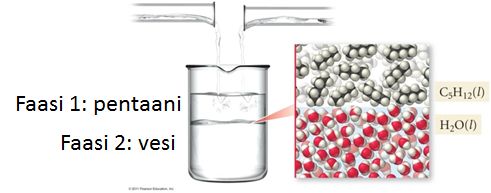
Veden ja pentaanin seoksessa esiintyvät seuraavat vuorovaikutukset:
- Vetysitoutuminen vesimolekyylien välillä
- Dispersionvuorovaikutukset pentaanimolekyylien välillä.
Vesi-vesivuorovaikutus on voimakas attraktiivinen vuorovaikutus ja pentaani-pentaanivuorovaikutus on heikompi attraktiivinen vuorovaikutus. Miksi nesteet eivät sekoitu? Tätä voidaan tarkastella kvalitatiivisesti seuraavasti. Jotta sekoittuminen tapahtuisi, täytyisi muodostua vesi-pentaanivuorovaikutusia. Kun seoksessa on kaksi faasia, on kokonaisvuorovaikutus summa vesimolekyylien välisistä ja pentaani molekyylien välisistä vuoraovaikutuksista. Koska liuokset eivät sekoitu, täytyy vuorovaikutusenergian vesi-pentaanivuorovaikutuksen tapauksessa olla suurempi (toisin sanoen vähemmän negatiivinen eli vähemmän attraktiivinen) kuin tapauksen, jossa nesteet pysyvät eri faaseissa. Näin sekoittuminen olisi energeettisesti epäedullista.
2.4.2 Pintajännitys
Nesteen pintajännitys on seurausta molekyylien välisistä vuorovaikutuksista. Nesteen sisällä jokainen molekyyli vuorovaikuttaa attraktiivisesti usean naapurimolekyylin kanssa. Jokainen vuorovaikutus alentaa vuorovaikutusenergiaa (toisin sanoen tekee vuorovaikutusenergiasta negatiivisemman eli voimakkaamin attraktiivisen). Nesteen pinnalla olevat molekyylit vuorovaikuttavat vain nesteessä olevien molekyylien kanssa ja siten niillä on vähemmän attraktiivista vuorovaikutusta. Niiden vuorovaikutusenergia on siten korkeampi kuin nesteen sisällä olevien molekyylien.

Kun sormella painetaan nestepintaan, kasvaa nestepinnan pinta-ala sen kaareutuessa sormenpään ympärille. Samalla pintamolekyylien määrä kasvaa ja siten nesteen kokonaisenergia kasvaa. Tällöin nesteen kokonaisenergia on kasvanut. Kun nestepinnalle asetataan kevyt esine se ei uppoa, koska pintajännitys estää sitä uppoamasta. Neste siis pyrkii pitämään nestemolekyylien määrän minimissä. Pieni napautus esineeseen ja se uppoaa, eli pintajännityksen voittamiseksi täytyy tehdä työtä.

Veden pyrkimys pisaramuotoon on myös seurausta pintajännityksestä ja pyrkimyksestä minimoidan pintamolekyylien määrä. Pallo on muoto, jossa pinta-alan suhde tilavuuteen on pienin. Näin vesi pyrkii pisaramuotoon, koska silloin sen energia on minimissään. Maanpinnalla vesipisaran muotoon vaikuttavat myös gravitaatio sekä ilmakehä.

Pintajännityksen voimakkuus riippuu molekyylien välisten vuorovaikutusten voimakkuudesta. Poolittomilla nesteillä pintajännitys on heikompi kuin esimerkiksi poolisilla nesteillä.
2.4.3 Kapillaari-ilmiö
Kapillaari-ilmiössä nestepatsas nousee ylöspäin kapillaarisessa (ohuessa) putkessa. Tämä on seurausta nesteen molekyylien vuorovaikutuksesta kapillaarin seinämien molekyylien kanssa.
2.4.4 Viskositeetti
Viskositeetilla tarkoitetaan aineen pyrkimystä vastustaa nesteen virtausta. Viskositeetti on seurausta molekyylien välisistä vuorovaikutuksista ja mitä voimakkaampia vuorovaikutukset ovat, sitä suurempi on aineen viskositeetti.
Lämpötilaa kasvatettaessa viskositeetti alenee, koska molekyylien kasvava liike-energia saa molekyylit liikkumaan vapaammin.
Viskositeetti on keskeisessä asemassa mm. autojen sekä koneiden moottoreissa. Isossa mittakaavassa viskositetti on merkittävä esimerkiksi pitkissä öljyputkissa, joissa raakaöljyä siirretään öljykentiltä jalostamoihin ja satamiin. Viskositeettiin voidaan vaikuttaa eri tavoin. Nesteeseen voidaan lisätä toista ainetta, jonka avulla viskositeettia voidaan alentaa tai kasvattaa tarpeen mukaan. Raakaöljyyn on sekoitettu mm. kerosiinia, jotta se saadaan kulkemaan putkissa.
Toisenlainen lähestymiskulma viskositeettiin löytyy moottoriöljyistä, joiden käyttölämpötilat voivat vaihdella n. \(-30-+90\,^\circ\text{C}\). Öljyn tulisi virrata ja voidella moottoria kylmässä ja toisaalta sen viskositeetti ei saa laskea liian alas moottorin lämmetessä. Moottoriöljyt sisältävät polymeerejä (molekyyliketjuja), joiden rakenne muuttuu lämpötilan muuttuessa. Alhaisessa lämpötilassa pitkät molekyyliketjut ovat kerällä, jolloin niiden vuorovaikutus on heikompaa kuin suoraketjuisena. Näin viskositeetti on kylmässä alhaisempi. Kun öljy lämpenee, on vaarana viskositeetin laskeminen liian alhaiseksi. Molekyylikerät avautuvat lämpötilan kasvaessa ja näin molekyylien vuorovaikutuspinta-ala kasvaa ja siten estää viskositeettiä laskemasta liian alhaiseksi.
These are the current permissions for this document; please modify if needed. You can always modify these permissions from the manage page.