5. Jaksollinen järjestelmä
Tässä osassa pääset tutustumaan tarkemmin kemistien ehkä tärkeimpään työkaluun: jaksolliseen järjestelmään. Olet varmasti sitä jo käyttänyt kemian opinnoissasi, mutta nyt syvennymme tarkemmin siihen, kuinka jaksollinen järjestelmä on muodostunut ja kuinka se liittyy elektronirakenteeseen. Kappaleeseen liittyvät tehtävät ovat omalla sivullaan. Kun koet, että osaat kappaleen asiat, voit testata osaamistasi myös monivalintatestillä.

5.1 Tavoitteet
Tavoitteena on, että tämän kappaleen jälkeen
- Tiedät pääpiirteittäin, kuinka jaksollinen järjestelmä on muodostunut
- Tiedät mitä jaksollisessa järjestelmässä tarkoitetaan jaksolla ja ryhmällä sekä tiedät mitä yhteistä on saman jakson/ryhmän alkuaineilla
- Osaat luokitella alkuaineet epämetalleihin, puolimetalleihin ja metalleihin jaksollisen järjestelmän avulla
- Osaat nimetä metalleille ja epämetalleille tyypillisiä ominaisuuksia
- Osaat päätellä atomin elektronirakenteen jaksollisen järjestelmän avulla
- Osaat jaksollisen järjestelmän avulla ennustaa millaisia ioneja pääryhmien 1, 2, 16 ja 17 alkuaineet muodostavat
- Osaat selittää alkuaineen ominaisuuksia jaksollisen järjestelmän avulla
5.2 Jaksollinen järjestelmä ja kemian kolme tasoa
Alkuaineet on alun perin järjestetty jaksolliseen järjestelmään niiden makroskooppisen tason ominaisuuksien eli aistein havaittavien ominaisuuksien mukaan. Jaksollisen järjestelmän avulla voimme kuitenkin päätellä hyvin paljon alkuaineatomin submikroskooppisen tason ominaisuuksista. Jaksollisen järjestelmän avulla voimme esimerkiksi kirjoittaa alkuaineatomin elektronirakenteen tai ennustaa millaisia ioneja se muodostaa. Tästä voimmekin päätellä, että submikroskooppiset ominaisuudet ennustavat voimakkaasti makroskooppisen tason ominaisuuksia.
Jaksollisessa järjestelmässä on valtava määrä tietoa alkuaineista symbolisella tasolla. Symbolien, kuten alkuaineiden kemiallisten merkkien, tunteminen on tarpeellista, jotta tietoa pystyisi hyödyntämään. Jaksollisessa järjestelmässä on kaikki maailmankaikkeuden alkuaineet. Kaikki ympärillämme olevat materiaalit, sinä itse mukaan lukien, koostuvat näistä alkuaineista.

5.3 Jaksollisen järjestelmän historia

Moderni jaksollinen järjestelmä perustuu venäläisen tiedemiehen Dmitri Mendeleevin (1834-1907) kehittämään jaksolliseen järjestelmään. Tähän aikaan ei tunnettu kuin noin 60 alkuainetta nykyisestä 118:sta alkuaineesta. Kemistit olivat kuitenkin selvittäneet monia näiden alkuaineiden ominaisuuksia, kuten niiden suhteelliset atomimassat ja joitakin kemiallisia ja fysikaalisia ominaisuuksia.
5.4 Jaksollisen järjestelmän ominaisuudet
Mendeleev järjesti jaksollisen järjestelmän kasvavan atomimassan ja ominaisuuksien jaksollisuuden mukaan. Tällöin ei vielä tunnettu atomin rakennetta, eikä elektroneja, protoneja tai neutroneja ollut vielä löydetty. Modernissa jaksollisessa järjestelmässä atomit on järjestetty kasvavan järjestysluvun mukaisesti eli ytimessä olevien protonien lukumäärän mukaan. On kuitenkin hyvä huomata, että järjestelyperiaatteen erosta huolimatta, alkuaineet ovat taulukossa lähes samoilla paikoilla. Mendeleevin ajan jälkeen jaksollinen järjestelmä on vain huomattavasti kasvanut, kun uusia alkuaineita on löydetty.
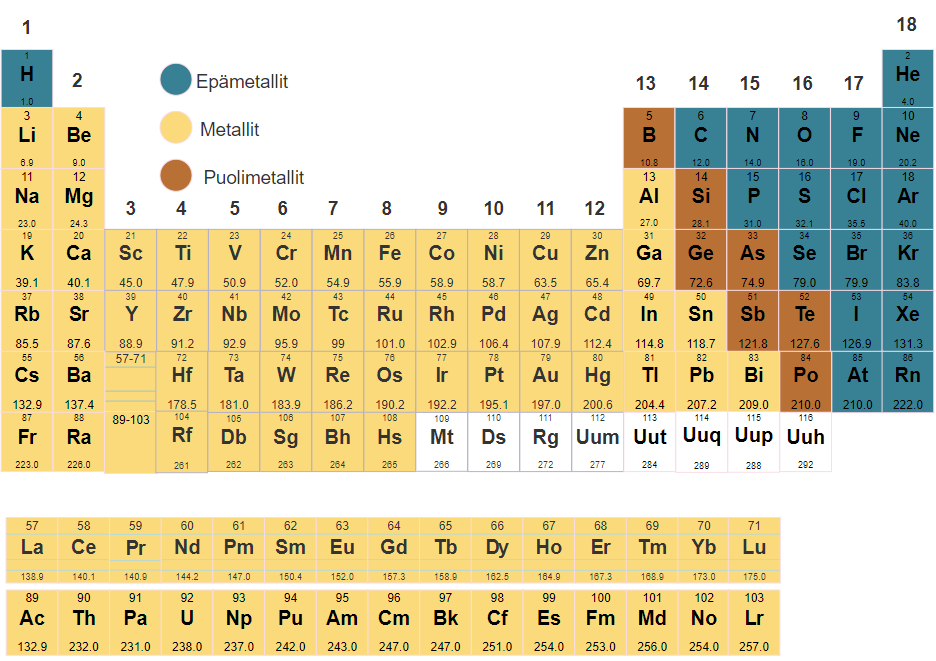
Jaksollinen järjestelmä on erittäin hyödyllinen työkalu kemiassa. Sen avulla voidaan päätellä alkuaineiden kemiallisia ja fysikaalisia ominaisuuksia. Esimerkiksi alkuaineet voidaan lajitella metalleihin, epämetalleihin ja puolimetalleihin jaksollisen järjestelmän paikan mukaan. Jaksollisen järjestelmän perusominaisuuksien ja keskeisen terminologian tunteminen on tärkeää.

Jaksollisen järjestelmän pystyrivejä kutsutaan ryhmiksi ja vaakarivejä jaksoiksi.
Ryhmiä 1, 2, 13, 14, 15, 16, 17 ja 18 kutsutaan pääryhmiksi. Usein pääryhmistä käytetään seuraavia nimiä:
- pääryhmä: Alkalimetallit
- pääryhmä: Maa-alkalimetallit
- pääryhmä: Booriryhmä
- pääryhmä: Hiiliryhmä
- pääryhmä: Typpiryhmä
- pääryhmä: Happiryhmä
- pääryhmä: Halogeenit
- pääryhmä: Jalokaasut
Pääryhmien väliin jääviä ryhmiä 3-12 kutsutaan sivuryhmiksi tai siirtymämetalleiksi. Osa kuudennen ja seitsemännen jakson aineista esitetään yleensä taulukosta erotettuina, jotta jaksollisesta järjestelmästä ei tulisi epäkäytännöllisen pitkä. Näitä nimitetään lantanoideiksi ja aktinoideiksi.
5.5 Metallit, epämetallit ja puolimetallit
Alkuaineet luokitellaan metalleihin, epämetalleihin ja puolimetalleihin. Suurin osa alkuaineista on metalleja ja ne sijaitsevat vasemmassa reunassa ja keskellä jaksollista järjestelmää. Epämetalleja on vähemmän ja ne sijaitsevat jaksollisen järjestelmän oikeassa reunassa. Puolimetalleilla tarkoitetaan sellaisia aineita, joilla on sekä metallisia että epämetallisia ominaisuuksia. Puolimetallien määrä on pieni ja ne sijaitsevat metallien ja epämetallien välissä.
Metalleille ominaisia ominaisuuksia ovat muun muassa
- Kiiltävyys
- Sähkön- ja lämmönjohtavuus
- Hyvä muokattavuus
- Korkeat sulamispisteet, joten yleensä kiinteitä huoneen lämpötilassa
- Luovuttavat helposti elektroneja ja muodostavat positiivisia ioneja
Epämetalleille ominaisia ominaisuuksia ovat muun muassa
- Johtavat huonosti sähköä ja lämpöä
- Huoneen lämpötilassa voivat olla joko kiinteitä, nesteitä tai kaasuja
- Vastaanottavat usein elektroneja ja muodostavat negatiivisia ioneja
Puolimetalleilla on sekä metallisia että epämetallisia ominaisuuksia.
5.6 Jaksollinen järjestelmä ja elektronirakenne
Alkuaineen paikasta jaksollisessa järjestelmässä voidaan päätellä aineen ominaisuuksia. Esimerkiksi ensimmäisen ryhmän alkuaineet, alkalimetallit, reagoivat hyvin kiivaasti veden kanssa. Toisaalta jalokaasut eivät osallistu helposti kemiallisiin reaktioihin. Mistä ryhmien samankaltaiset ominaisuudet johtuvat?
Tarkastellaan pääryhmien sekä jaksojen elektronirakenteita dynaamisen jaksollisen järjestelmän avulla. Avaa linkki välilehteen ja valitse ylävalikosta “atomiorbitaali”, jotta pääset tarkastelemaan nimenomaan elektronirakennetta.
Kysymykset
Pääryhmä määrää uloimmalla kuorella olevien elektronien lukumäärän ja jakson numerosta selviää, millä kuorella ulkoelektronit ovat.
Esimerkki
Happi ja rikki sijaitsevat allekkain jaksollisessa järjestelmässä. Miten näiden elektronirakenne eroaa toisistaan?
Vastaus
Hapen (O) järjestysluku on 8, joten sillä on 8 protonia ja myös 8 elektronia, kun puhutaan neutraalista atomista. Hapen elektronirakenne voidaan kirjoittaa seuraavasti: Nähdään, että hapella on uloimmalla kuorella (2. kuorella) 2 elektronia 2s-alikuorella ja 4 elektronia 2p-alikuorella eli yhteensä 6 elektronia uloimmalla kuorella.
Rikin (S) järjestysluku on 16, joten sillä on 16 elektronia. Rikin elektronirakenne voidaan kirjoittaa seuraavasti: Nähdään, että rikillä on uloimmalla kuorella (3. kuorella) 2 elektronia 3s-alikuorella ja 4 elektronia 3p-alikuorella eli yhteensä 6 elektronia uloimmalla kuorella.
Hapen ja rikin elektronirakenne on hyvin samankaltainen, mutta rikin ulkoelektronit ovat yhtä energiatasoa korkeammalla kuin hapen ulkoelektronit
5.7 Jaksollinen järjestelmä ja ionit
Jaksollisen järjestelmän avulla voidaan yleensä päätellä, luovuttaako vai vastaanottaako atomi elektroneja. Luovutettujen ja vastaanotettujen elektronien lukumäärä eli ionin varaus, pystytään yleensä ennustamaan etenkin pääryhmien alkuaineille.
Kemiallisissa reaktioissa metalleilla on taipumus luovuttaa elektroneja ja muodostaa positiivinen ioni (kationi). Epämetalleilla on vastaavasti taipumus vastaanottaa elektroneja ja muodostaa negatiivinen ioni (anioni).

Alkalimetalleilla on uloimmalla kuorellaan yksi elektroni, josta ne luopuvat helposti saavuttaakseen lähimmän jalokaasun elektronirakenteen, joka on energeettisesti suotuisampi. Tästä syystä alkalimetallit ovat hyvin reaktiivisia. Alkalimetallit muodostavat 1+ ioneja. Alkalimetalleja ei löydy luonnosta puhtaina alkuaineina niiden reaktiivisuudesta johtuen, vaan ne ovat aina osana yhdisteitä.
Maa-alkalimetallit ovat alkalimetallien tavoin hyvin reaktiivisia ja luonnossa niitä löytyy vain yhdisteistä. Toisen pääryhmän alkuaineina niillä on kaksi ulkoelektronia, jotka ne luovuttavat helposti ja muodostavat näin 2+ ioneja.
Mitä kauempana elektroni on ytimestä, sitä vähemmän energiaa tarvitaan sen irrottamiseen atomista. Tästä syystä alkalimetallien ja maa-alkalimetallien reaktiivisuus lisääntyy ryhmää alaspäin mentäessä.
Happiryhmän kaikilla alkuaineilla on kuusi elektronia uloimmalla kuorellaan. Saavuttaakseen lähimmän jalokaasun energeettisesti edullisen elektronirakenteen, happiryhmän epämetallit ottavat vastaan kaksi elektronia. Muodostuu 2- ioni, koska negatiivisia elektroneja on kaksi enemmän kuin positiivisia protoneja ytimessä.
Halogeeneilla on seitsemän elektronia uloimmalla kuorellaan, joten niiden täytyy ottaa vastaan vain yksi elektroni saavuttaakseen lähimmän jalokaasun elektronirakenteen ja muodostavat näin negatiivisen ionin. Halogeenit reagoivat herkästi metallien kanssa, muodostaen suoloja. Halogeenien nimikin tarkoittaa suolan muodostajaa, sillä kreikaksi halos tarkoittaa suolaa ja gennan synnyttäjää. Luonnossa halogeeneja ei esiinny vapaina alkuaineina, vaan ainoastaan yhdisteissä. Halogeeneilla reaktiivisuus lisääntyy ryhmää ylöspäin mennessä ja ryhmän ensimmäinen jäsen (fluori) onkin alkuaineista kaikkein reaktiivisin.
Jalokaasuilla on uloimmalla kuorella 8 elektronia eli täydet s- ja p-orbitaalit. Tätä elektronirakennetta kutsutaan usein myös oktetiksi. Tämä on energeettisesti suotuisin vaihtoehto, joten jalokaasujen elektronirakenne on hyvin pysyvä. Tästä syystä jalokaasut eivät yleensä osallistu kemiallisiin reaktioihin, vaan ovat hyvin passiivisia.
5.8 Tehtävät ja lisämateriaali
Muita linkkejä opiskelun tueksi:
- Reaktiivisimman metallin ja reaktiivisimman epämetallin reaktio (video): Reaction Fluorine with Caesium
- Jaksollinen järjestelmä palapeli
These are the current permissions for this document; please modify if needed. You can always modify these permissions from the manage page.